微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使得其在制药、燃料、 农药等化学工业中有许多独特的用途。
(1)已知:2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-25 kJ.mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下。
CH3OCH3(g)+H2O(g) △H=-25 kJ.mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下。
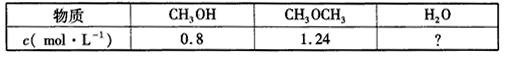
①平衡时,c(CH3OCH3)等于____mol.L-1,反应混合物的总能量减少____kJ。
②若在平衡后的容器中再加入与起始时等量的CH3OH,请在如图中画出CH3OH的浓度和转化率随时间变化的曲线。

(2)在直接以甲醚为燃料的电池中,电解质溶液为酸性,则负极反应式为____,正极反应式为___
(3)已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71 kJ. mol-1
②CO(g)+2H2(g)=CH3OH(l) △H=-90.5 kJ.mol-1
③CH4(g) +2O2(g)=CO2(g) +2H2O(l) △H=- 890 kJ. mol-1
则甲醇的燃烧热为___。若CO的燃烧热为282.5 kJ.mol-1,则H2的燃烧热为___。
参考答案:(1)①1.6;40
② 
(2)CH3OCH3-12e-+3H2O=2CO2+12H+?; O2 +4H+ +4e-=2H2O
(3)764 kJ.mol-1;286 kJ . mol-1
本题解析:
本题难度:一般
2、选择题 如图所示是Zn和Cu构成的原电池,某实验兴趣小组做完实验后,在读书卡片上做了一些记录。在卡片上,描述合理的是

[? ]
A.①②③
B.③④⑤
C.④⑤⑥
D.②③④
参考答案:B
本题解析:
本题难度:一般
3、填空题 烧过菜的铁锅未及时洗去含有NaCl的残液,过一段时间便出现红棕色的铁锈斑点,已知该锈斑为Fe(OH)3
失水的产物。
(1)请你写出此时Fe被腐蚀的电极反应式:负极______________,正极_______________。
(2)Fe2+和NaOH溶液反应生成Fe(OH)2的离子方程式:____________________。
(3)Fe(OH)2与O2和水反应转化为Fe(OH)3的化学方程式:____________________。
参考答案:(1)Fe-2e-=Fe2+;2H2O+O2+4e-=4OH-
(2) Fe2++2OH-=Fe(OH)2↓
(3)4Fe(OH)2+2H2O+O2=4Fe(OH)3
本题解析:
本题难度:一般
4、简答题 按如图装置进行实验,并回答下列问题:
(1)锌极为______极,电极反应式为______,石墨棒C1为______极,电极反应式为______,石墨棒C2附近发生的实验现象为______.
(2)当C2极析出224mL气体(标准状态)时,锌的质量减少______g.
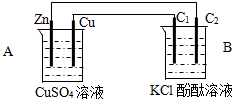
参考答案:(1)A能自发的进行氧化还原反应,能将化学能转化为电能,活泼性较强的Zn为负极,电极反应式为Zn-2e-=Zn2+;活泼性较弱的Cu为正极,石墨棒C1与正极相连为阳极,阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2;石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,所以阴极附近有气泡,溶液变红,
故答案为:负;Zn-2e-=Zn2+;阳;2Cl--2e-=Cl2;有气泡,溶液变红;
(2)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=0.224L22.4L/mol=0.01mol,则转移的电子为0.02mol,Zn电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g,
故答案为:0.65.
本题解析:
本题难度:一般
5、选择题 国外新近研制的溴化锌蓄电池的基本构造是用碳棒作两极,溴化锌溶液作电解液.?现有四个电极反应:①Zn-2e=Zn2+?②Zn2++2e=Zn?③Br2+2e=2Br-?④2Br--2e=Br2.那么,充电时的阳极和放电时的负极反应分别是( )
A.④①
B.②③
C.③①
D.②④
参考答案:用碳棒作电极,充电时,该装置是电解池,阳极上溴离子失电子生成溴单质而发生氧化反应;
放电时,该装置是原电池,负极上锌失电子生成锌离子而发生氧化反应,
故选A.
本题解析:
本题难度:一般