|
高中化学必备知识点《离子共存》高频试题预测(2017年最新版)(四)
2017-07-18 02:47:22
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在某种接近中性的含Na+的无色溶液中,可能还存在NH4+、Ca2+、Br-、MnO4-、CO32-、I-、SO32-七种离子中的某几种。①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。根据上述实验事实推断,该溶液中肯定不存在的离子为
A.NH4+、Br-、CO32-、MnO4-
B.NH4+、SO32-、I-、Ca2+
C.Ca2+、I-、MnO4-、SO32-
D.Ca2+、CO32-、I-、SO32-
|
参考答案:C
本题解析:无色溶液中不可能存在MnO4-;在原溶液中滴加足量氯水后,有气泡产生,说明溶液中可能存在CO32-、SO32-;溶液呈橙黄色,则溶液中一定存在Br-,氯气与Br-发生置换反应生成溴单质,使溶液呈橙黄色;向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成,说明溶液中不存在SO32-,否则会有硫酸钡产生;则溶液中一定存在CO32-;则一定不存在Ca2+;橙黄色溶液不能使淀粉变蓝,则溶液中不存在I-,铵根离子不能确定,所以原溶液中一定不存在的离子是Ca2+、I-、MnO4-、SO32-,答案选C。
考点:考查常见离子的检验
本题难度:一般
2、计算题 Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
阴离子
| SO42-、NO3-、Cl-
| 阳离子
| Fe3+、Fe2+、NH4+、Cu2+、Al3+
|
?
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是?。
(2)原溶液中含有的阳离子是?。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为?。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为?。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
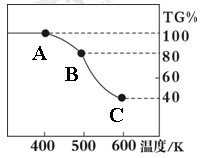
(5)草酸亚铁晶体中碳元素的化合价为:?
(6)A→B发生反应的化学方程式为?。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为:?;释放第二种气体时,反应的化学方程式为?。
参考答案:(16分,每空2分)(1)溶液呈红色(2分)?(2)Fe2+、Cu2+?(2分);
(3)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O(2分)?(4)160.0g(2分)(写成160g不给分);
(5)+3(2分)?(6)FeC2O4·2H2O FeC2O4 +2H2O(2分) FeC2O4 +2H2O(2分)
(7)CO(2分)? FeCO3 FeO +?CO2↑(2分) FeO +?CO2↑(2分)
本题解析:Ⅰ.若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和具有还原性的Fe2+。若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-。各离子的物质的量均为1mol,因此根据电荷守恒可知还应含有Cu2+,所以原溶液中所含阳离子是Fe2+、Cu2+,阴离子是NO3-、Cl-、SO42-。
(1)如果先加入盐酸,在酸性条件下NO3-具有氧化性,能和具有还原性的Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。所以再滴入KSCN溶液,溶液呈红色。
(2)原溶液中含有的阳离子是Fe2+和Cu2+。
(3)根据以上分析可知,向原溶液中加入足量的盐酸,发生反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。
(4)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,最终得到的固体应该是是CuO、Fe2O3。根据题意各离子的物质的量均为1mol可知,m(CuO)=1.0mol×80g/mol=80.0g,m(Fe2O3)=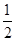 ×1.0mol×160g/mol=80.0g,所得固体的质量为80.0g+80.0g=160.0g。 ×1.0mol×160g/mol=80.0g,所得固体的质量为80.0g+80.0g=160.0g。
Ⅱ.(5)草酸亚铁晶体(FeC2O4·2H2O)中铁元素的化合价是+2价,氧元素是-2价,所以碳元素的化合价是(2×4-2)÷2=+3价。
(6)根据草酸亚铁晶体的化学式FeC2O4·2H2O可知,晶体中结晶水的含量是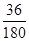 ×100%=20%,所以A→B发生反应恰好是失去结晶水,因此反应的化学方程式为FeC2O4·2H2O ×100%=20%,所以A→B发生反应恰好是失去结晶水,因此反应的化学方程式为FeC2O4·2H2O FeC2O4 +2H2O。 FeC2O4 +2H2O。
(7)草酸亚铁晶体中FeO的含量是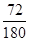 ×100%=40%,所以C点生成的固体是氧化亚铁。由于第二步释放的气体的相对分子质量较第一步的大,所以第一步释放的是CO,第二步释放的是CO2,反应的化学方程式分别是FeC2O4 ×100%=40%,所以C点生成的固体是氧化亚铁。由于第二步释放的气体的相对分子质量较第一步的大,所以第一步释放的是CO,第二步释放的是CO2,反应的化学方程式分别是FeC2O4 FeCO3+CO、FeCO3 FeCO3+CO、FeCO3 FeO +?CO2↑。 FeO +?CO2↑。
本题难度:困难
3、填空题 (12分)某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
(2)用离子方程表达下列反应:
①中生成气体A:___________ __。
②中生成溶液H:____________ _。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
参考答案:(每空2分共14分)(1) Fe3+、Cl-
(2)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
Al3+ +4OH-=AlO2-+2H2O
(3)0.15 0.1 0
本题解析:强酸性溶液中一定不存在CO32-、SO32-,则与过量的硝酸钡溶液反应,生成9.32g沉淀,则该沉淀是硫酸钡沉淀,物质的量是9.32g/233g/mol=0.04mol,说明溶液中存在0.04mol SO42-,则一定不存在Ba2+;与过量硝酸钡反应生成的气体A可连续被氧化,说明A是NO,D是二氧化氮,则溶液中存在与硝酸发生氧化还原反应的离子,为Fe2+,所以溶液中一定不存在NO3-;溶液B中含有铁离子和过量的硝酸钡,加入氢氧化钠溶液仍产生气体,说明原溶液中存在NH4+,氨气的物质的量也是铵根离子的物质的量是0.112L/22.4L/mol=0.005mol;则沉淀G中一定含有氢氧化铁;通入过量的二氧化碳,仍能产生沉淀,因为铁离子上步中被完全沉淀,所以此时产生的沉淀只能是氢氧化铝,说明溶液中存在铝离子;而Fe3+、Cl-不能确定。
(1)根据以上分析,不能确定溶液X中是否含有的阳、阴离子分别是Fe3+、Cl-;
(2)①硝酸与亚铁离子发生氧化还原反应生成铁离子、NO和水,离子方程式是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
②中生成溶液H,即为铝离子和过量的氢氧化钠反应生成偏铝酸钠和水,离子方程式是Al3+ +4OH-=AlO2-+2H2O;
(3)根据生成NO的体积可计算亚铁离子的浓度,NO的物质的量是0.112L/22.4L/mol=0.005mol,则亚铁离子的物质的量是0.005mol×3=0.015mol,c(Fe2+)=0.015mol/0.1L=0.15mol/L;加入氢氧化钠溶液60mL时沉淀量降到0.025mol,说明此时为氢氧化铁沉淀,亚铁离子的物质的量是0.015mol,所以说明原溶液中存在铁离子,其物质的量是0.025mol-0.015mol=0.01mol,则c(Fe3+)=0.01mol/0.1L=0.1mol/L;加入55mL氢氧化钠溶液时沉淀达到最大值0.03mol,加入60mL氢氧化钠溶液时,沉淀降为0.025mol,说明氢氧化铝的物质的量是0.03mol-0.025mol=0.005mol,则溶液中SO42-:0.04mol,NH4+:0.005mol,Fe2+:0.015mol,Fe3+:0.01mol,Al3+:0.005mol,此时2n(SO42-)=n(NH4+)+2n(Fe2+)+3n(Fe3+)+3n(Al3+),所以c(Cl-)=0mol/L。
考点:考查离子的检验与计算
本题难度:困难
4、选择题 在下列给定条件的水溶液中,一定能大量共存的离子组是
A.能与铝反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl-
B.存在大量Fe2+的溶液:H+、Na+、NO3-、SO42-
C.由水电离出的c(H+)=10-12mol/L的溶液:Na+、K+、Cl-、NO3-
D.常温下,c(H+)∶c(OH-)=1×10-12的溶液:K+、Ba2+、ClO-、CO32-
参考答案:C
本题解析:A 不能共存。能与铝反应生成H2的溶液显酸性或碱性,HCO3-不与酸、碱共存。
B 不能共存。H+、NO3-与Fe2+发生氧化还原反应。
C 能共存,溶液显酸性或者碱性,这些离子都能共存
D 不能共存,c(H+)∶c(OH-)=1×10-12的溶液显碱性,但Ba2+、CO32-不能共存,生成沉淀。
本题难度:一般
5、选择题 下列可以大量共存且形成无色溶液的一组离子应该是
A.Ag+、Cu2+、NO3-、Na+
B.NO3-、Fe3+、Mg2+、SO42-
C.Na+、Ca2+、Cl-、CO32-
D.K+、Ba2+、Cl-、NO3-
参考答案:D
本题解析:A?Cu2+是蓝色溶液。
B?Fe3+是黄色溶液。
C?Ca2+、CO32-不能共存。
D 能共存,且形成无色溶液。选D
本题难度:一般
| 