微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应A+B="C+D" 为放热反应,对该反应的下列说法中正确的是:
A.A的能量一定高于C
B.B的能量一定高于D
C.A和B的能量总和一定高于C和D的能量总和
D.因该反应为放热反应,故不必加热就可自发进行
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列说法中正确的是
A.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析
B.开发核能、太阳能等新能源,推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
C.光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质
D.阴极射线、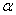 -粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献
-粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献
参考答案:A
本题解析:使用无磷洗涤剂不能直接降低碳排放,故B错误;
光导纤维、油脂不是由高分子化合物组成的物质,故C错误;
布朗运动的发现不是用来研究原子结构的;1827年,苏格兰植物学家R·布朗发现水中的花粉及其它悬浮的微小颗粒不停地作不规则的曲线运动,称为布朗运动。(实际上,花粉等颗粒实际上是受到周围水分子的碰撞而运动的,但水分子的运动是无法通过显微镜观察出来的)
布朗运动并不是水分子的运动,但是它是水分子无规则运动的反映。故D错误;
本题难度:一般
3、选择题 下列叙述正确的是(?)
A.生成物总能量一定低于反应物总能量
B.分解反应一定是吸热反应
C.应用盖斯定律,可计算某些难以直接测量的反应的焓变
D.同温同压下,H2(g)+Cl2(g)
参考答案:C
本题解析:A 错误,如果是放热反应,生成物总能量一定低于反应物总能量
B 错误,有的分解反应是放热反应。
C 正确,设计途径,可计算某些难以直接测量的反应的焓变
D 错误,H2(g)+Cl2(g)?2HCl(g)的起态和终态相同,△H就相同,与反应条件无关。
本题难度:一般
4、实验题 用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。

?
| 起始温度t1/℃
| 终止温度
t2/℃
| 温度差
(t2-t1) /℃
|
HCl
| NaOH
| 平均值
|
1
| 25. 91eXAm.org5
| 25.0
| 25.25
| 28.5
| 3.25
|
2
| 24.5
| 24.5
| 24.50
| 27.5
| 3.00
|
3
| 25.0
| 24.5
| 24.75
| 26.5
| 1.75
|
(1)在该实验中,量取50 mL 盐酸或NaOH 溶液,需要用到的玻璃仪器_________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________________________温度。
(4)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ )。
(5) 如果用50 mL 0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是
________________________?。
参考答案:(1)量筒、胶头滴管? (2)减少实验过程中的热量损失
(3)完全反应后混合溶液的最高温度? (4) 1.31 kJ?
(5) NH3·H2O是弱电解质,不能完全参加中和反应(或生成的盐会水解,要吸收热量等)
本题解析:(1)该实验量取盐酸或氢氧化钠溶液体积的玻璃仪器是量筒和胶头滴管。
(2)该实验过程中应该尽可能的减小热量的损失,所以装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失。
(3)根据实验原理可知,记录的终止温度是指完全反应后混合溶液的最高温度。
(4)根据表中数据可知,实验3的数据误差大,舍去。因此温度变化的平均值是(3.25℃+3.00℃)÷2=3.125℃。溶液的质量是100g,所以反应中放出的热量是4.18J/(g·℃ )×100g×3.125℃=1306.25J=1.31kJ。
(5)△H会偏大,说明反应中放出的热量减少。这是由于NH3·H2O是弱电解质,存在电离平衡,而电离是吸热的。
本题难度:一般
5、选择题 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A.A的能量一定高于C
B.B的能量一定高于D
C.A和B的能量总和一定高于C和D的能量总和
D.因该反应为放热反应,故不必加热就可自动进行
参考答案:C
本题解析:放热反应的生成物总能量一定高于低于反应物总能量,即A和B的能量总和一定高于C和D的能量总和,答案为C
本题难度:一般