|
|
|
高中化学知识点大全《能量的相互转化》高频试题强化练习(2017年最新版)(六)
2017-07-18 02:50:38
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列图示与对应的叙述相符的是
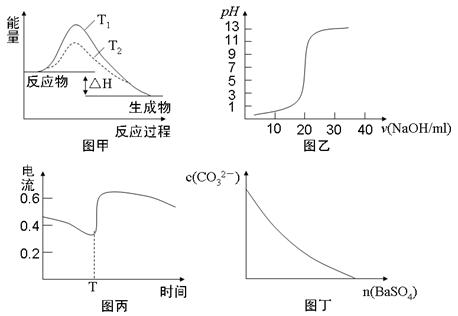
A.图甲表示T1>T2,SO2与O2反应过程中的能量变化
B.图乙表示0.1000mol·L-1NaOH溶液滴定20.00ml0.1000mol·L-1CH3COOH溶液所得到的滴定曲线
C.图丙表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2
D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化
参考答案:C
本题解析:A、同一反应,温度不同,反应热不同,A错误;B、0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液消耗20ml溶液恰好反应生成醋酸钠,溶液呈碱性,另外曲线的起点,pH应大于1,故B错误;C、H2O2有较强的氧化性,反应更剧烈,电流会变大,C正确;D、在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)先变小,溶解达到平衡状态后,c(CO32-)不会变成0。选C
本题难度:一般
2、选择题 下列反应属于吸热反应的是
A.C6H12O6(葡萄糖aq)+6O2 =6CO2+6H2O
B.CH3COOH+KOH = CH3COOK+H2O
C.A+B= C+D;△H<0
D.反应物的总键能大于生成物的总键能
参考答案:D
本题解析:焓变△H=反应物的总键能—生成物的总键能>0,说明是吸热反应;或者可以这样理解:打开旧键需要吸热,生成新键是放热,由于反应物的总键能大于生成物的总键能,所以吸收的热量多。
本题难度:一般
3、填空题 硫酸氢钠(NaHSO4)在水溶液中可以完全电离为Na+和HSO ,HSO ,HSO 在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO 在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO 。不过,在浓度大的溶液中HSO 。不过,在浓度大的溶液中HSO 不能完全电离,而是与H+、SO 不能完全电离,而是与H+、SO 共同存在于同一溶液中。 共同存在于同一溶液中。
(1)硫酸氢钠(NaHSO4)所属的物质类别是(?)
A.酸
B.盐
C.碱
D.氧化物
| (2)NaHSO4溶液的pH?7。(填“>”“<”或“=”=
(3)在稀NaHSO4溶液中加入Na2CO3溶液时,可以得到无色、无味的气体,该气体可以使澄清石灰水变浑浊。写出稀NaHSO4溶液与Na2CO3溶液反应的化学方程式和离子方程式。
参考答案:(1)B?(2)<
(3)2NaHSO4+Na2CO3 2Na2SO4+H2O+CO2↑ 2Na2SO4+H2O+CO2↑
2H++CO  H2O+CO2↑ H2O+CO2↑
本题解析:HSO 可以看成H2SO4电离产生的一种酸根离子,这样硫酸氢钠可看成是由金属阳离子Na+与酸根阴离子HSO 可以看成H2SO4电离产生的一种酸根离子,这样硫酸氢钠可看成是由金属阳离子Na+与酸根阴离子HSO 组成的,因而它是一种盐。由于硫酸氢钠电离出的阳离子并不都是H+,因此它既不属于酸也不属于一般的盐,而是一种酸式盐。 组成的,因而它是一种盐。由于硫酸氢钠电离出的阳离子并不都是H+,因此它既不属于酸也不属于一般的盐,而是一种酸式盐。
由于HSO 电离可以产生H+,故其水溶液应该显酸性,其pH<7。 电离可以产生H+,故其水溶液应该显酸性,其pH<7。
稀NaHSO4溶液与Na2CO3溶液反应得到的无色、无味、可使澄清石灰水变浑浊的气体应该是二氧化碳。HSO 在稀溶液里完全电离为H+和SO 在稀溶液里完全电离为H+和SO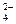 ,则NaHSO4溶液与Na2CO3溶液的反应实质上就是H+与CO ,则NaHSO4溶液与Na2CO3溶液的反应实质上就是H+与CO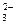 的反应。 的反应。
本题难度:一般
4、填空题 将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:______________。
问题2:不同化学反应进行的快慢和程度千差万别。在复杂的反应中,要考虑反应的先后顺序。已知NH4++AlO2-+H2O=Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中
(1)第二个离子反应的离子方程式是?
(2)最后一个离子反应的离子方程式是?
问题3:化学反应的复杂性决定了反应方程式计量数的复杂性。对下列化学反应:
8KMnO4+15Kl+17H2SO4→8MnSO4+5I2+5KIO3+9 K2SO4+17H2O
如果该反应方程式中I2和KIO3的系数不是5,可能的配平系数还有许多组。请你再写出一个配平的该反应的化学方程式:?。
问题4:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:?。
参考答案:问题l:改变影响平衡的一个条件。平衡将向能够减弱这种改变的方向移动。
问题2:(1)第二个反应为:Al3++3OH-=Al(OH)3↓
(2)最后一个离子反应为:Ai(OH)3+OH-=AlO2-+2H2O
问题3:4KMnO4+5Kl+7H2SO4→4MnSO4+I2+3KlO3+3K2SO4+7H2O
(其他合理答案也正确)
问题4:C(金刚石、s)=C(石墨、s):△H=-1.90kJ/mol.
本题解析:略
本题难度:简单
5、简答题 (14分)从能量的变化和反应的快慢等角度研究反应: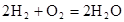 。 。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂
B.提高氧气的浓度
C.提高反应的温度
D.降低反应的温度
|
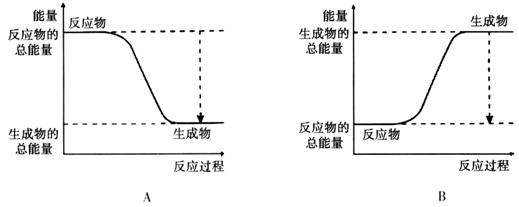
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。已知:化学键的键能:?
化学键
| H—H
| O=O
| H—O
|
键能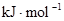
| 436
| 496
| 463
|
由此计算2molH2在氧气中燃烧生成气态水放出的热量
?(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
?(5)氢氧燃料电池的总反应方程式为
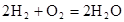
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
参考答案:(1)? ABC?(2)A?(3)484KJ
(4)2H2 (g)+ O2(g)=2H2O(l)? △H=-4QKJ/mol? (5)负?氧化? 2.24L
本题解析:(1)A. 使用催化剂可以大大加快正反应速率。正确。B. 因为氧气是反应物。提高氧气的浓度,及增大反应物的浓度,可以加快化学反应速率。正确。正确。C. 提高反应的温度。可以加快化学反应速率。正确。D. 降低反应的温度,减慢化学反应速率。错误。(2)由于已知该反应为放热反应。则反应物的能量高于生成物的能量,在发生反应时多余的能量释放出来。图像应该为A。(3)断裂化学键吸收能量,形成化学键释放能量,反应过程中的能量变化就是二者的差值,所以2molH2在氧气中燃烧生成气态水放出的热量是2mol×436kJ/mol+1mol×496 kJ/mol-4mol×463 kJ/mol=484KJ.即氧气中燃烧生成气态水的热反应方程式为2H2 (g)+ O2(g)=2H2O(g)。ΔH=-484KJ/mol. (4)因为1克氢气完全燃烧生成液态水放出QKJ的热量,所以氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+ O2(g)=2H2O(l)? △H=-4QKJ/mol。(5)在氢氧燃料电池中通入氢气的电极为负极,负极发生氧化反应,n(e-)=0.2mol。则n(H2)=0.1mol. 在标准状况下消耗H2的体积是V=0.1mol×22.4L/mol=2.24L.
本题难度:一般

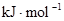
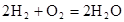 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。