微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
A.R的原子半径比Z的大
B.R的氢化物的热稳定性比W的强
C.X与Y形成的化合物只有一种
D.Y的最高价氧化物的水化物的酸性比W的
参考答案:B
本题解析:X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,则X为H元素;Z的二价阳离子与氖原子具有相同的核外电子排布,则Z为Mg,W原子最外层电子数是最内层电子数的3倍,最外层电子数为6,结合原子序数可知,W为S,故R为Cl,Y的最高正价与最低负价的代数和为0,处于ⅣA族,原子序数小于Mg,故Y为C元素,A、Z为Mg、R为Cl,二者同周期,原子序数依次增大,原子半径减小,故A错误;B、非金属性Cl>S,故氢化物稳定性HCl>H2S,故B正确;C、H与C元素形成烃类物质,化合物种类繁多,故C错误;D、Y、W的最高价氧化物的水化物分别为碳酸、硫酸,碳酸是弱酸,而硫酸是强酸,故D错误,故选B。
本题难度:一般
2、选择题 下列关于卤素(用X表示)的叙述正确的是( )。
A.其单质都能与水反应,通式为X2+H2O=HX+HXO
B.HX易溶于水,其水溶液都是强酸
C.其单质都有颜色,都有毒
D.最高价含氧酸的通式为HXO4
参考答案:C
本题解析:本题考查卤素及有关化合物的基本知识规律,解答好本题,除掌握一般规律外,要注意F2及氟的化合物的特殊性:①F2与水反应置换H2O中的氧生成O2,不像其他卤素单质,②F是最强的非金属,在化合物中不表现正价,HF的溶液表现弱酸性。
本题难度:一般
3、选择题 已知A、B元素同周期,且电负性A<B,下列说法正确的是?(?)
A.A与B形成化合物时,A显正价,B显负价且A原子的半径小于B原子的半径
B.A与B形成的共价化合物分子一定是极性分子
C.气态氢化物的稳定性:HmB小于HnA
D.最高价含氧酸的酸性:A对应的酸性弱于B对应的酸性
参考答案:D
本题解析:略
本题难度:简单
4、填空题 下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
族
周期
| IA
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ⑦
| ?
| ?
| ⑧
| ?
|
?
(1)④、⑤、⑥的原子半径由大到小的顺序为(元素符号)________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________?。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为?。
(6)若用①②组成最简单的有机物作为燃料电池的原料,请写出在碱性介质中燃料电池负极的电极反应式:?。
(7)燃煤废气中的含有氮氧化物(NOx)、二氧化碳等气体,常用下列方法对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物。
如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) , △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?, △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为?。
参考答案:(1)Na>Al>O……(2分)
(2)HNO3>H2CO3>H2SiO3 (H4SiO4) ……(2分)
(3)NaOH或NaClO……(2分)
(4)2Mg + CO2 2MgO + C………?(2分)
2MgO + C………?(2分)
(5)2Al + 2OH- + 2H2O =2AlO2- + 3H2↑………(2分)
(6)CH4-8e- +10OH-=CO32- +7H2O………(2分)
(7)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)?△H=-867 kJ·mol-1 … (2分)
本题解析:根据元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,则
(1)Na、Al位于同一周期,Na原子半径大于Al,O原子核外电子层数最少,原子半径最小,则原子半径:Na>Al>O;
(2)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则酸性:HNO3>H2CO3>H2SiO3。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物为NaOH或NaClO。
(4)由②和④组成的化合物可以是二氧化碳或一氧化碳,⑤的同周期相邻主族元素的单质是镁,镁能与二氧化碳反应生成氧化镁和碳,反应的化学方程式为2Mg + CO2 2MgO + C。
2MgO + C。
(5)⑥单质是铝,与⑤的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al + 2OH- + 2H2O =2AlO2- + 3H2↑。
(6)①②组成最简单的有机物是甲烷,甲烷作为燃料电池中甲烷在负极通入,所以在碱性介质中燃料电池负极的电极反应式为CH4-8e- +10OH-=CO32- +7H2O。
(7)已知①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1、②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1,则根据盖斯定律可知(①+②)÷2即得到CH4(g)将NO2(g)还原为N2(g)等的热化学方程式,即CH4(g) +2NO2(g)=N2(g) +CO2(g) +2H2O(g),所以该反应的反应热△H=(-574 kJ·mol-1-1160 kJ·mol-1)÷2=-867 kJ·mol-1。
本题难度:一般
5、填空题 下表是元素周期表的一部分,针对表中①~⑩中的元素,回答以下问题:
①
| ?
| ?
|
?
| ?
| ?
| ?
| ②
| ③
| ④
| ⑤
| ?
|
⑥
| ⑦
| ⑧
| ?
| ?
| ?
| ⑨
| ?
|
| ?
| ?
| ?
| ?
| ?
| | ?
| ?
| ?
| ?
| ?
| ?
| ?
| | ?
| ⑩ | ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)在表中a、b、c、d四个区域中,全部是金属元素的区域为 ?。
(2)在①~⑨元素中,原子半径最大的是? ?(填元素名称);①和③组成的化合物的电子式为?;⑨的离子结构示意图为?。
(3)元素的最高价氧化物对应的水化物中酸性最强的是?(填化学式,下同),碱性最强的是 ?,呈两性的是?。
(4)⑨和⑩中,非金属性较强的是?(填元素符号);可用一个化学反应说明该事实,写出该反应的离子方程式:?。
参考答案:(每空1分,共9分)
(1)b
(2)钠,?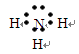 ?,
?,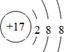 ?
?
(3)HClO4,NaOH,Al(OH)3?
(4)Cl, Cl2+2Br-=2Cl-+Br2
本题解析:(1)b的区域中是过度金属,故全部是金属元素的区域b。
(2)同周期,自左向右,原子半径逐渐减小;同主族,自上向下,原子半径逐渐增大。故原子半径最大的是⑥,即钠。①和③组成的化合物是NH3,电子式为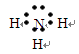 。⑨是Cl,其离子结构示意图为
。⑨是Cl,其离子结构示意图为 。
。
(3)同周期,自左向右,金属性逐渐减弱,非金属性逐渐增强;同主族,自上向下,金属性逐渐增强,非金属性逐渐减弱。元素的非金属性越强,其最高价氧化物对应的水化物中酸性最强,故为HClO4。元素的金属性越强,其最高价氧化物对应的水化物碱性最强的,故为NaOH。呈两性的是Al(OH)3。
(4)同周期,自左向右,金属性逐渐减弱,非金属性逐渐增强;同主族,自上向下,金属性逐渐增强,非金属性逐渐减弱。故非金属性⑨大于⑩,非金属性较强的是Cl。证明非金属性强弱的化学反应的离子方程式为Cl2+2Br-=2Cl-+Br2。
点评:本题考查学生元素周期表和元素周期律的综合知识,是一道综合题,难度较大。
本题难度:一般