| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《水的电离平衡》高频试题强化练习(2017年最新版)(八)
参考答案:A 本题解析:A项水的电离过程为吸热过程,升高温度促进水的电离,水的离子积增大,pH减小;B项CO2通入漂白粉水溶液中发生反应:CO2+Ca(ClO)2+H2O=CaCO3+CO2↑+H2O,继续通入又会发生反应:CaCO3+CO2+H2O=Ca(HCO3)2↓,溶液又变澄清;C项同类型的难溶化合物,Ksp越小越容易生成,所以:Ksp(AgCl)>Ksp(AgI);D项溶液中含有H+ 、NO3-,也容易将Fe2+氧化为Fe3+,所以结论错误。 本题难度:一般 2、填空题 某地的酸雨中,含c (Na+) = 7.0×10-6mol/L,c (Cl-) = 4.5×10-5 mol/L,c (NH4+) = 2.3×10-5 mol/L,c (SO42-) = 2.5×10-6 mol/L,则该地酸雨的pH约为 。. 参考答案:4.7 本题解析:根据电荷守恒可知,氢离子浓度是4.5×10-5 mol/L+2.5×10-6 mol/L×2-7.0×10-6mol/L-2.3×10-5 mol/L=2.4×10-5 mol/L,所以pH=4.7。 本题难度:一般 3、选择题 下列有关溶液的叙述中,正确的是 |
参考答案:D
本题解析:A、10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸含有的CH3COOH物质的量相等,所以中和时所需同种碱溶液的量相等,错误;B、因为酸的强弱和碱的强弱不明确,所以常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH不确定,错误;C、常温下,体积相等、pH相同的盐酸和硫酸溶液,c(HCl)=2c(H2SO4),错误;D、常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等,都是0.001mol?L?1。
考点:本题考查酸碱中和反应、弱电解质的电离、pH的判断。
本题难度:一般
4、选择题 下列关于水的电离不正确的是
A.加酸或碱一定抑制水的电离
B.加盐一定促进水的电离
C.升高温度,水的pH值变小
D.常温下任何稀的酸、碱、盐水溶液中KW=10-14
参考答案:B
本题解析:H2O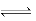 H++OH-,A、加酸或碱,增加c(H+)或c(OH-),增加生成物的浓度,反应向逆反应方向进行,抑制水的电离,说法正确,不符合题意;B、加盐不一定促进水的电离,可能不影响水的电离,如NaCl,也可能抑制,如NaHSO4,也可能促进水的电离,如AlCl3,说法不正确,符合题意;C、水的电离是吸热反应,升高温度促进水的电离,c(H+)增大,pH变小,说法正确,不符合题意;D、Kw只受温度的影响,常温下,水的离子积10-14,说法正确,不符合题意。
H++OH-,A、加酸或碱,增加c(H+)或c(OH-),增加生成物的浓度,反应向逆反应方向进行,抑制水的电离,说法正确,不符合题意;B、加盐不一定促进水的电离,可能不影响水的电离,如NaCl,也可能抑制,如NaHSO4,也可能促进水的电离,如AlCl3,说法不正确,符合题意;C、水的电离是吸热反应,升高温度促进水的电离,c(H+)增大,pH变小,说法正确,不符合题意;D、Kw只受温度的影响,常温下,水的离子积10-14,说法正确,不符合题意。
考点:考查影响水电离的因素、水的离子积等知识。
本题难度:一般
5、填空题 取两支试管,分别加入4mL0.01mol/L的KMnO4溶液,然后向试管①中加入0.1mol/LH2C2O4溶液2mL,记录溶液褪色所需的时间;向试管②中加入0.2mol/L H2C2O4溶液2mL,记录溶液褪色时间,(1)实验表明 褪色更快些。
(2)写出反应的化学方程式 。
(3)在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- ⑥C2O42-、Br-、K+、Cl-
参考答案:
本题解析:略
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《铝》高频考.. | |