|
高考化学知识点整理《化学基本概念》高频考点强化练习(2017年最新版)(十)
2017-07-27 08:09:53
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向含有FeCl3、BaCl2的酸性溶液中通入SO2气体会有沉淀产生,该沉淀是
A.BaSO4
B.FeS
C.BaSO3
D.S
|
参考答案:A
本题解析:铁离子具有氧化性,能把SO2氧化生成硫酸,进而生成白色沉淀硫酸钡,答案选A。
考点:考查物质的化学性质
点评:该题属于基础性试题,难度不大,关键是记住常见物质的化学性质。
本题难度:一般
2、选择题 可逆反应N2+3H2===2NH3(正反应是放热反应)达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法都正确的是
A.升高温度、降低压强、增加氮气
B.降低温度、增大压强、加入催化剂
C.升高温度、增大压强、增加氮气
D.降低温度、增大压强、分离出部分氨
参考答案:D
本题解析:
本题难度:困难
3、选择题 向蒸馏水中加入一定量的NaHSO3晶体,保持常温,测得溶液的pH=4,下列说法正确的是
A.水电离出的H+的浓度是1.0×10-4 mol·L-1
B.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3)
C.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-)
D.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3)
参考答案:D
本题解析:考点:离子浓度大小的比较;弱电解质在水溶液中的电离平衡;水的电离;盐类水解的应用.
分析:测得溶液的pH=4,说明溶液呈酸性,溶液中HSO3-离子的电离程度大于水解程度,结合弱电解质的电离和盐类的水解原理以及溶液中的电荷守恒、质子守恒、物料守恒解答该题.
解:A.测得溶液的pH=4,说明HSO3-电离出的H+的浓度是1.0×10-4mol?L-1,水电离出的H+的浓度等于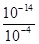 mol?L-1=1.0×10-10mol?L-1,故A错误; mol?L-1=1.0×10-10mol?L-1,故A错误;
B.根据物料守恒可知,Na元素的物质的量与S元素的物质的量相等,则存在c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故B错误;
C.根据电荷守恒,溶液中存在c(HSO3-)+2c(SO32-)+c(OH-)=c(Na+)+c(H+),根据无聊守恒,溶液中存在c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),二者联式可得:c(H+)+c(H2SO3)-c(SO32-)=c(OH-),故C错误;
D.溶液的pH=4,说明溶液呈酸性,溶液中HSO3-离子的电离程度大于水解程度,则c(SO32-)>c(H2SO3),一般来说,弱电解质的电离程度都较小,应有c(HSO3-)>c(SO32-),则c(HSO3-)>c(SO32-)>c(H2SO3),故D正确.
故选D.
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.在0℃,压强为101×105Pa时,22.4L Cl2与HCl的混合气体中含有的氯原子总数为3NA
B.0.5molI—被氧化时失去的电子数为0.5NA
C.0.113 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
D.常温常压下,48gO3含有氧原子数为3NA
参考答案:D
本题解析:A错,氯气分子中含有2个氯原子,而HCL分子中只有1个,由于不知道它们各自的物质的量,所以,原子总数无法计算;B错,I—被氧化时不一定生成碘单质;C错,NH4+离子会发生水解,所以0.113 mol·L-1的NH4NO3溶液中含有的NH4+数目小于0.3×6.02×1023;
D正确,48gO3的物质的量为1mol,即含有氧原子数为3NA
本题难度:困难
5、选择题 根据下图,下列判断中正确的是

A.烧杯a中的溶液pH升高
B.烧杯b中发生还原反应
C.烧杯a中发生的反应为2H++2e-=H2
D.烧杯b中发生的反应为2Cl--2e-=Cl2
参考答案:A
本题解析:试题分析:图中锌电极为负极、铁电极为正极,b中电极反应为Zn-2e-=Zn2+,发生氧化反应,B、D错误;a中电极反应为O2+2H2O+4e-=4OH-,pH增大,A正确、C错误。
考点:原电池
点评:根据图中外电路电子流向可知Zn为负极、Fe为正极。原电池中负极失电子被氧化,发生氧化反应;正极表面阳离子得电子被还原发生还原反应。
本题难度:一般
|