|
高考化学知识点总结《有关氧化还原反应的计算》考点预测(2017年强化版)(八)
2017-07-27 08:12:48
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是(?)
A.1molNH5中有5NA个N—H键(NA为阿伏加德罗常数)
B.NH5中既有共价键、又有离子键,是离子晶体
C.NH5跟水的反应是氧化还原反应
D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
参考答案:A
本题解析:A、1molNH5中E有4mol的共价键和1mol的离子键,错误。
本题难度:一般
2、选择题 Murad等三位教授最早提出了NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖,关于NO的下叙述不正确的?
A.NO可以是某些低价N物质被氧化产物
B.NO能导致臭氧层空洞
C.NO可以是某些高价N物质被还原产物
D.NO是红棕色气体
参考答案:D
本题解析:NO是无色气体,故D错误
本题难度:一般
3、选择题 将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入过量的NaOH溶液,产生21.4g沉淀.推断气体x的成分可能是
A.0.3molNO2
B.0.2molNO2和0.1molN2O4
C.0.1molNO、0.2molNO2和0.05molN2O4
D.0.6molNO
|
参考答案:C
本题解析:21.4g沉淀是氢氧化铜和氢氧化镁的混合物,则与金属阳离子结合的氢氧根是21.4g—11.2g=10.2g,物质的量是10.2g÷17g/mol=0.6mol,所以金属与硝酸的反应中失去0.6mol电子。A、0.3molNO2需要转移0.3mol电子,不符合电子得失守恒,A错误;B、0.2molNO2和0.1molN2O4共计转移0.2mol+0.1mol×2=0.4mol电子,不符合电子得失守恒,B错误;C、0.1molNO、0.2molNO2、0.05molN2O4共计转移0.1mol×3+0.2mol+0.05mol×2=0.6mol电子,符合电子得失守恒,C正确;D、0.6molNO转移0.6mol×3=1.8mol电子,不符合电子得失守恒,D错误,答案选C。
考点:考查氧化还原反应的有关计算
本题难度:一般
4、填空题 (5分)用化学用语填空。
⑴地壳中含量最高的金属元素的元素符号是??;
⑵硫离子的离子符号?;
⑶氯离子的离子结构示意图?;?
⑷H2SO3中硫元素的化合价为?;
⑸硫酸铝的化学式?。
参考答案:⑴Al? ⑵S2-?⑶ ? ⑷+4? ⑸Al2(SO4)3 ? ⑷+4? ⑸Al2(SO4)3
本题解析:地壳中含量最高的元素是O、Si、Al、Fe,含量最高的金属元素是Al。硫元素最外层有6个电子,易得到2个电子达到稳定结构,因此硫离子符号是S2-,氯元素的原子序数是17,
氯离子的结构示意图为 ,H2SO3中氧为-2价,氢为+1价,所以硫为+4价。硫酸铝 ,H2SO3中氧为-2价,氢为+1价,所以硫为+4价。硫酸铝
中硫酸根为-2价,铝离子为+3价,因此硫酸铝的化学式为Al2(SO4)3。
点评:要想准确的答此题,必须正确熟练的掌握化学用语。
本题难度:一般
5、填空题 为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
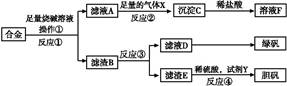
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
实验编号
| ①
| ②
| ③
| ④
| 稀硝酸体积(mL)
| 100
| 200
| 300
| 400
| 剩余金属质量(g)
| 9.0
| 4.8
| 0
| 0
| NO体积(L)
| 1.12
| 2.24
| 3.36
| V
|
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
参考答案:(1)烧杯、漏斗、玻璃棒
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)取少量滤液D加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色最后变成红褐色(合理即可)
(4)Cu+H2O2+H2SO4+3H2O=CuSO4·5H2O(或Cu+H2O2+H2SO4=CuSO4+2H2O)
(5)铁粉与杂质铜形成原电池,加快了反应速率 因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O 晶体
(6)2 mol/L 4.8 g 4.48
本题解析:(1)操作①是过滤。(2)金属中只有铝能和氢氧化钠溶液反应生成AlO2-, AlO2-和足量CO2生成Al(OH)3沉淀和HCO3-。(3)滤液D中含有Fe2+,可以利用其和碱生成沉淀时的颜色变化、自身不能使KSCN溶液变红而氧化后变红的性质进行检验。(4)H2O2是绿色氧化剂,还原产物是H2O。(5)里面有杂质铜,形成原电池,加快了反应速率;Fe3+很易发生水解。(6)滤渣B中含有Fe和Cu,分析实验①到②和②到③的过程可知:①到②时,金属过量,硝酸完全反应,100 mL HNO3共产生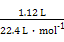 ="0.05" mol NO,消耗金属4.2 g,由反应: ="0.05" mol NO,消耗金属4.2 g,由反应:
3Fe + 8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
3×56 g 8 mol 2 mol
4.2 g 0.2 mol 0.05 mol
知:消耗的4.2 g金属恰好为Fe,且可推知①中消耗的也为Fe且质量为4.2 g,同时求得HNO3的浓度为: ="2" mol·L-1。又由反应: ="2" mol·L-1。又由反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3×64 g 2 mol
m(Cu) 0.05 mol
得:m(Cu)=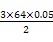 g="4.8" g可知:②到③中溶解的4.8 g金属恰好是Cu,即铜的总质量即为4.8 g;根据前面的分析可知:④与③相比多加的100 mL HNO3是与Fe2+反应: g="4.8" g可知:②到③中溶解的4.8 g金属恰好是Cu,即铜的总质量即为4.8 g;根据前面的分析可知:④与③相比多加的100 mL HNO3是与Fe2+反应:
3Fe2+ + 4H+ + NO3-=3Fe3++NO↑+2H2O
3 mol 4 mol 1 mol 22.4 L
0.15 mol 0.2 mol0.2 mol V′
即V′= ="1.12" L。 ="1.12" L。
故V=3.36+1.12=4.48。
本题难度:困难
|