微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应3S+6KOH(浓) 2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是?(? )?
2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是?(? )?
A.3∶1
B.1∶3
C.2∶1
D.1∶2
参考答案:C
本题解析:考查氧化还原反应的有关判断和计算。根据元素化合价的变化可知,单质硫既是还原剂,也是氧化剂。其中2mol硫的化合价由0价降低到-2价,作氧化剂。另外1mol化合价从0价升高到+4价,作还原剂,因此氧化剂和还原剂的质量之比是2︰1,答案选C。
本题难度:一般
2、填空题 (8分)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4C1、FeC1?3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 ?(写化学式)。
(2)写出并配平该反应的化学方程式: ?;
(3)当转移的电子总数为a个时,氮气物质的量变化了bmol,阿伏加德罗数常数为(用含a、b的代数式表示)?。
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 ? 。
。
参考答案:

本题解析:略
本题难度:一般
3、计算题 在900℃的空气中合成出一种含镧、钙和锰 (摩尔比2 : 2 : 1) 的复合氧化物,其中锰可能以 +2、+3、+4 或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析:
⑴ 准确移取25.00 mL 0.05301 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5 mL 6 mol·L-1的HNO3溶液,微热至60~70oC,用KMnO4溶液滴定,消耗27.75 mL。写出滴定过程发生的反应的方程式;计算KMnO4溶液的浓度。
⑵ 准确称取0.4460 g复合氧化物样品,放入锥形瓶中,加25.00 mL上述草酸钠溶液和30 mL 6 mol·L-1的HNO3溶液,在60~70oC下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。已知La的原子量为138.9。
参考答案:⑴2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
KMnO4溶液浓度: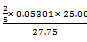 ?=" 0.01910" (mol·L-1)
?=" 0.01910" (mol·L-1)
⑵根据:化合物中金属离子摩尔比为 La : Ca : Mn =" 2" : 2 : 1,镧和钙的氧化态分别为+3和+2,锰的氧化态为 +2 ~ +4,初步判断
复合氧化物的化学式为La2Ca2MnO6+x, 其中x = 0~1。
滴定情况:
加入C2O42-总量:25.00 mL ×0.05301 mol·L-1=" 1.3253" mmol
样品溶解后,滴定消耗高锰酸钾:10.02 mL ×0.01910 mol·L-1 =" 0.1914" mmol
样品溶解后剩余C2O42-量:? 0.1914 mmol × =" 0.4785" mmol
=" 0.4785" mmol
样品溶解过程所消耗的C2O42-量: 1.3253 mmol -0.4785 mmol =" 0.8468" mmol
在溶样过程中,C2O42-变为CO2给出电子:
2 × 0.8468 mmol =" 1.694" mmol
有两种求解x的方法:
(1)方程法:
复合氧化物(La2Ca2MnO6+x)样品的物质的量为:
0.4460 g / [(508.9 + 16.0 x) g·mol-1]
La2Ca2MnO6+x中,锰的价态为: [2 ×(6+x) -2 ×3 -2×2] = (2+2x)
溶样过程中锰的价态变化为: (2+2 x- 2) =" 2" x??
锰得电子数与C2O42-给电子数相等:
2 x× 0.4460 g / [(508.9 + 16.0 x) g·mol-1] =" 2" ×0.8468 ? 10-3 mol
x =" 1.012" ≈1?
(2)尝试法
因为溶样过程消耗了相当量的C2O42-,可见锰的价态肯定不会是+2价。若设锰的价态为+3价,相应氧化物的化学式为La2Ca2MnO6.5, 此化学式式量为516.9 g·mol-1, 称取样品的物质的量为:
0.4460 g / (516.9 g·mol-1) =" 8.628" ×10-4 mol
在溶样过程中锰的价态变化为
1.689× 10-3 mol / (8. 628×10-4 mol) =" 1.96"
锰在复合氧化物中的价态为:? 2 + 1.96 =" 3.96?"
3.96与3差别很大,+3价假设不成立;?
而结果提示Mn更接近于+4价。?
若设Mn为+4价, 相应氧化物的化学式为La2Ca2MnO7, 此化学式式量为524.9 g·mol-1。
锰在复合氧化物中的价态为:2 + 2 × 0.8468 ×10-3 / (0.4460 / 524.9) =" 3.99" ≈ 4?
假设与结果吻合,可见在复合氧化物中,Mn为+4价。?
该复合氧化物的化学式为La2Ca2MnO7
溶样过程的反应方程式为:
La2Ca2MnO7 + C2O42- + 14H+ = 2La3+ + 2Ca2+ + Mn2+ + 2CO2 + 7H2O
本题解析:⑴此过程为标准溶液的标定,根据关系式5C2O42-~2MnO4-,用C2O42-标准溶液标定出MnO4-的浓度。
⑵该分析过程属于容量分析的返滴定类型,用KMnO4滴定过量的C2O42-。根据电子得失守恒关系,可列出下式
Mn元素得失电子数+5×n(MnO4-)=2×n(C2O42-)
求得Mn元素得失电子的物质的量为1.694 mmol
设复合氧化物的通式(La2Ca2MnO6+x),求得氧化物中Mn的物质的量,进而求得滴定过程中锰元素氧化数的变化,最终确定氧化物中锰的氧化数。
本题难度:一般
4、实验题 (共12分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。?
?MnO4- +?H2O2?+?H+?="=" ?Mn2+?+?O2?+?(? )
(3)移取10mL过氧化氢溶液可以用_________________(填“酸式”或“碱式”)滴定管。不用碱式滴定管盛装KMnO4标准液的原因是?,滴定到达终点的现象是__________? _____________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为_________________________________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果_________(填“偏高”或“偏低”或“不变”)。
参考答案:(1)容量瓶(1分)(2)2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2↑+8H2O(分子式1分,配平2分,共3分)
(3)酸式 (1分)?高锰酸钾具有强氧化性,会使橡皮管老化? (2分)溶液由无色变为紫红色,且半分钟内不褪色(2分)?(4) 2.5cv(2分)?(5)偏高(2分)
本题解析:(1)准确配制一定体积一定物质的量浓的溶液用容量瓶,故答案为:容量瓶;(2)方程式中,高锰酸钾有强氧化性,能将双氧水氧化为氧气,先确定缺的是O2,锰元素化合价降低了5价,生成1mol氧气时,氧元素化合价升高2价,根据电子转移守恒,配平化学方程式高锰酸根前面的系数为2,双氧水前面的系数为5,根据原子守恒来配平其他物质前面的系数,2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2↑+8H2O。(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管,滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,故答案为:酸式;滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。(4)根据化学方程式可以得到关系式:2MnO4-~5H2O2,耗用c mol/L KMnO4标准溶液V mL,即cV×10-3mol的高锰酸钾时,所用双氧水的物质的量:2.5cV×10-3mol。(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
本题难度:一般
5、填空题 铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式____________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式__________________________________________________。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式__________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式________________________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H2O的质量分数为____________。
参考答案:(14分)(1)3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑(2分)
(2)Cu+H2O2+2H+=Cu2++2H2O(2分)(3)Cu2O和Cu2S(2分) 0.3(2分)
(4)2Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O(2分)(若写成Cu-2e-=Cu2+得1分)
(5)2Cu2++4I-=2CuI↓+I2(2分)  ×100%(2分)
×100%(2分)
本题解析:(1)硝酸是氧化性酸,能氧化大部分金属,因此铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑。
(2)双氧水具有氧化性,在酸性条件下能被铜氧化成铜离子,而双氧水的还原产物是水,因此溶出铜的离子方程式为Cu+H2O2+2H+=Cu2++2H2O。
(3)根据方程式2Cu2O+ Cu2S 6Cu+SO2可知,反应中铜元素的化合价从+1价降低到0价,得到1个电子,因此氧化剂是该反应的氧化剂是Cu2O和Cu2S;S元素的化合价从-2价升高到+4价,失去6个电子,即Cu2S是还原剂。19.2gCu的物质的量=
6Cu+SO2可知,反应中铜元素的化合价从+1价降低到0价,得到1个电子,因此氧化剂是该反应的氧化剂是Cu2O和Cu2S;S元素的化合价从-2价升高到+4价,失去6个电子,即Cu2S是还原剂。19.2gCu的物质的量= =0.3mol,则当生成19.2gCu时,反应中转移的电子的物质的量=0.3mol×1=0.3mol。
=0.3mol,则当生成19.2gCu时,反应中转移的电子的物质的量=0.3mol×1=0.3mol。
(4)原电池中负极失去电子,发生氧化反应。所以生成铜锈的过程中负极的电极反应式为2Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O。
(5)滴加KI溶液后有白色碘化物沉淀生成,这说明反应中铜元素的化合价从+2价降低+1价,得到1个电子。而反应中碘离子失去电子被氧化生成单质碘,因此该反应的离子方程式为2Cu2++4I-=2CuI↓+I2;根据方程式2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6可知:
CuSO4·5H2O~Na2S2O3
1?1
0.001cVmol? 0.001cVmol
所以ag试样中CuSO4·5H2O的物质的量=0.001cVmol× =0.004cVmol
=0.004cVmol
质量=0.004cVmol×250g/mol=cVg
因此试样中CuSO4·5H2O的质量分数为 ×100%
×100%
本题难度:困难