微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中(?)
A.氧化产物与还原产物的物质的量之比为2∶5
B.氧化产物与还原产物的物质的量之比为5∶2
C.氧化剂与还原剂的物质的量之比为1∶8
D.氧化剂与还原剂的物质的量之比为5∶1
参考答案:B
本题解析:根据方程式可知,Mn元素的化合价从+7价降低到+2价,得到2个电子。氯元素的化合价从-1价升高到0价,失去1个电子。所以根据电子的得失守恒可知,氧化剂与还原剂的物质的量之比为1∶5,氧化产物与还原产物分别是氯气和氯化锰,所以二者的物质的量之比为5∶2,答案选B。
点评:在进行氧化还原反应的计算时,需要利用好电子的得失守恒这一关系式。
本题难度:一般
2、填空题 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q 184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
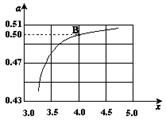
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)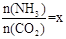 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
(3)图中的B点处,NH3的平衡转化率为 。
(4)已知: 3Cl2+2NH3→N2+6HCl
参考答案:
本题解析:
本题难度:困难
3、填空题 配平该化学方程式______K37ClO3+______H35Cl-______KCl+______Cl2+______H2O.
该反应中HCl体现了______性,若反应中有1.5mol电子发生转移生成Cl2______mol,所得Cl2的相对分子质量是______(保留小数点后一位).
参考答案:KClO3中Cl元素的化合价由+5价降低为0价,HCl中Cl元素的化合价由-1价升高到0,根据电子守恒及质量守恒定律来配平,所以其方程式为:1K37ClO3+6H35Cl=1KCl+3Cl2 ↑+3H2O,该反应氯化氢中部分氯元素失电子、部分化合价不变,所以氯化氢体现了酸性和还原性,根据方程式知,转移5mol电子生成3mol氯气,所以若反应中有1.5mol电子发生转移生成Cl2的物质的量=1.5mol×3mol5mol=0.9mol,其平均摩尔质量=0.9mol×2×16(37+35×5)g/mol0.9mol=70.7g/mol,所以其平均相对分子质量为70.7,
故答案为:1,6,1,3,3;酸性和还原性;0.9,70.7.
本题解析:
本题难度:一般
4、选择题 将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)="0.1" mol/L,则下列叙述中错误的是(?)
A.反应中消耗的Zn的质量为97.5 g
B.气体A中SO2和H2的体积比为1∶4
C.反应中被还原的元素只有一种
D.反应中共转移电子3 mol
参考答案:C
本题解析:解答本题应注意以下两点:
(1)生成的33.6 L气体可能是SO2和H2的混合气体。
(2)假设反应的Zn一部分还原出SO2,一部分还原出H2,设未知数、列方程式计算。
设气体A中SO2、H2的物质的量分别为x、y。
则根据两个反应方程式可知
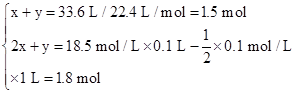
解得x="0.3" mol? y="1.2" mol
消耗Zn的质量为(x+y)×65 g/mol="97.5" g,转移电子数为3 mol,被还原的元素有S、H两种。
本题难度:一般
5、选择题 铁氧体(Fe3O4)法是处理含铬废水的常用方法。其原理是用FeSO4把废水中Cr2O72-离子还原为Cr3+离子,并通过调节废水pH,使生成物组成符合类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物 ·
· 。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则
。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则
A.x=1,y=4,z=6
B.x=0.5,y=1.5,z=8.5
C.x=2,y=4,z=6
D.x=2,y=6,z=4
参考答案:D
本题解析:略
本题难度:简单