|
高考化学必考知识点《气体的净化、干燥、吸收与收集》试题预测(2017年最新版)(二)
2017-07-27 08:17:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室制取下列气体时,不能用排气法收集,而只能用排水法收集的是(?)
A.NH3
B.Cl2
C.CO2
D.NO
参考答案:D
本题解析:本题考查了气体的收集方法,根据气体的密度、溶解性等性质分析。A、NH3的密度比空气小,与空气中的氧气不反应,可用向下排空气法收集;NH3极易溶于水,与水反应生成一水合氨,不能用排水法收集,错误;B、Cl2的密度比空气大,与空气中的氧气不反应,可用向上排空气法收集;Cl2能溶于水,与水反应生成盐酸和次氯酸,不能用排水法收集,错误;C、CO2的密度比空气大,与空气中的氧气不反应,可用向上排空气法收集;CO2能溶于水,不能用排水法收集,错误;D、NO和氧气反应,不能用排空气法收集;NO不溶于水和水不反应,可以用排水法收集,正确。
本题难度:一般
2、实验题 (4分)实验室用乙醇和浓H2SO4反应制取乙烯时,常发现反应混合液变黑,同时制得的乙醇具有刺激性气味,它是浓H2SO4氧化了乙醇的缘故。试求:
现有以下盛放于洗气瓶中的药品:
A.溴水
B.浓NaOH溶液
C.澄清石灰水
D.酸性KMnO4 E.品红溶液,请设计实验方案证明所制得的乙烯中混有CO2、SO2,同时乙烯能与溴水反应。
| ①写出气体通过洗气瓶时试剂放置的先后顺序(可重复选用)?。
②证明存在SO2的实验现象是?;
③证明存在CO2的实验现象是?,
④证明C2H4与溴水反应的实验现象是?。
参考答案:①EECBA
②第一个洗气瓶中品红褪色
③澄清石灰水变浑浊
④溴水褪色
本题解析:略
本题难度:简单
3、实验题 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因___________________________________________。
(2)装置C的作用是____________________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①________;②________。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。
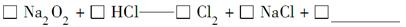
该反应________(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是____________________________________________(要求答出要点)。
参考答案:(1)Cl2 4H++4I-+O2=2I2+2H2O(或4I-+O2+2H2O=2I2+4OH-)
(2)吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气
(3)①Na2O2被还原时氧元素的化合价应该降低,不可能得到O2
②O2有可能是Na2O2与盐酸中的H2O反应生成的
(4) 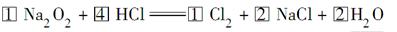
不能 实验室没有可直接使用的干燥HCl气体的物质;固体与气体反应较慢;产生的氯气中含有大量的氯化氢气体(答出任何一点即可,其他合理答案均可)
本题解析:(4)选择Na2O2、Cl2配平,Na2O2中氧的化合价降低2价、生成氯气化合价升高2价,所以Na2O2、Cl2的化学计量数均为1,再配NaCl的化学计量数为2。
本题难度:一般
4、实验题 (共14分)用18mol/L的浓硫酸配制3mol/L的稀硫酸100mL,按正确的操作顺序,将序号
填入括号内并填写下列空格。
(? )用少许蒸馏水洗涤小烧杯,将洗涤液沿_______注入__________并重复2次。
(? )将浓硫酸沿烧杯壁慢慢注入盛有少量蒸馏水的小烧杯中,并用玻璃棒不断搅拌。
(? )用量筒取浓硫酸______mL。
(? )将容量瓶盖紧摇匀。
(? )将已冷却的硫酸溶液沿________?注入________?中。
(? )改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切。
(? )继续向容量瓶内小心加蒸馏水,直至接近刻度线__________cm处。
若实验遇到下列情况,对所配溶液中硫酸的物质的量浓度有何影响(填偏高、
偏低、无影响)。
(1)?用量筒量取浓硫酸时俯视刻度线___________;
(2)?稀释过程中不慎有硫酸液滴溅出____________;
(3)?未将洗涤液加入容量瓶___________;
(4)?定容时仰视刻度线__________;
(5)?摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(6)?配制前容量瓶用水洗涤后未进行干燥处理__________。
参考答案:(操作顺序2分,其它每空1分)
(4) 玻璃棒? 100ml容量瓶
(2)
(1) 16.7ml
(7)
(3)玻璃棒? 100ml容量瓶
(6)
(5)1~2cm
(1)~(5)偏低,(6)无影响
本题解析:
1.实验步骤及仪器:
计算→称量(量取)→溶解(稀释)→冷却→转移→洗涤→振荡→定容→摇匀→装瓶贴签
2.注意事项
① 根据所配溶液的体积选取相应规格的容量瓶。如配950mL某浓度溶液应选1000mL的容量瓶,确定溶质时,不能按照950mL计算,要按照1000mL计算。
② 容量瓶在使用前要检查是否漏水。
方法:a.加水→倒立→观察→正立。
b.瓶塞旋转1800→倒立→观察。
经检查不漏水的容量瓶才能使用,使用前必须把容量瓶洗涤干净,但不必干燥。
③ 容量瓶中不能将固体或浓溶液直接溶解或稀释,不能作为反应容器,也不能用来长期贮存溶液。
④ 溶液注入容量瓶前需恢复至室温。向容量瓶里转移溶液或加入蒸馏水时,都要用玻璃棒引流。
⑤ 当容量瓶中液体占容积2/3左右时应进行摇匀。
⑥ 在容量瓶的使用过程中,移动容量瓶,手应握在瓶颈刻度线以上部位,以免瓶内溶液受热而发生体积变化,使溶液浓度不准确。
⑦ 在读取容量瓶内液体体积时,要使眼睛的视线与容量瓶的刻度线平行。当液体凹液面与容量瓶的刻度线恰好相切时,立即停止滴加蒸馏水。
⑧ 实验结束后及时洗净容量瓶。
3.根据c=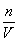 = =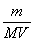 , 判断所配溶液的误差可能由n、V或m、V引起 , 判断所配溶液的误差可能由n、V或m、V引起
本题难度:简单
5、填空题 (14分)欲用36.5%(密度为1.18g/cm3)的浓盐酸配制浓度为1.00mol/L的稀盐酸500mL。

(1)选用的主要玻璃仪器有:①?②?③?④?⑤?。
(2)现有下列配制操作,正确的操作顺序为:?(填字母)
A.用量筒量取浓盐酸;
B.反复颠倒摇匀;
C.用胶头滴管加水至刻度线;
D.洗净所用仪器,洗涤液也转入容量瓶;E.稀释浓盐酸;F.溶液冷却后转入容量瓶。
|