微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,反应N2 (g)+3H2 (g) 2NH3(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有
2NH3(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有
A.升高温度
B.增大N2浓度
C.减小压强
D.加入催化剂
参考答案:B
本题解析:正反应是放热反应,升高温度,平衡向逆反应方向移动,则c(H2)/c(NH3)与原平衡相比应该是变大,A不正确;增大N2浓度,平衡向正反应方向移动,则c(H2)/c(NH3)与原平衡相比应该是变小,B正确;正反应是就减小的,所以减小压强,平衡向逆反应方向移动,则c(H2)/c(NH3)与原平衡相比应该是变大,C不正确;催化剂不能改变平衡状态,比值不变,所以答案选B。
本题难度:一般
2、选择题 下列有关说法正确的是
A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) =2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大
D.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
参考答案:B
本题解析:A项,该反应是气体体积增大的反应,即熵增大,而反应不自发,则反应为吸热反应,即?H>0,错;B项,铁铜构成原电池,铁作负极,加快了铁的腐蚀,正确;C项,该反应为放热反应,升高温度,平衡逆向移动,H2的转化率减小,错;D项,Kw=c(H+)c(OH-),升高温度,Kw增大,即c(H+)、c(OH-)增大,说明升温促进了水的电离,故可说明水的电离为吸热反应,错。
【考点定位】化学反应原理的分析
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
本题难度:一般
3、填空题 (8分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加入B(体积不变),则A的转化率_________,B的转化率_________。(填“增大”“减小”或“不变”,下同)
(3)若升高温度,则平衡时B、C的浓度之比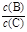 将_________。
将_________。
参考答案:(8分)(1) >? (2)增大?减小? (3)减小
本题解析:(1)当升高温度时,B的转化率变大,所以正反应是吸热反应;当减小压强时,混合体系中C的质量分数减小,说明正反应是体积减小的反应,所以m+n>P。
(2)增大B的浓度,平衡向正反应方向移动,所以A的转化率增大,但B的转化率减小。
(3)正反应是吸热的,所以升高温度,平衡向正反应方向移动,因此B、C的浓度之比将减小。
本题难度:一般
4、填空题 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生反应: N2(g) + 3H2(g)  ?2NH3(g)
?2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a=?。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量=?。
(3)原混合气体与平衡混合气体的总物质的量之比n(始)∶n(平)=?。
(4)原混合气体中,a∶b=?。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= ?。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=?。
参考答案:(每空2分,共12分)
(1)16(2)8 mol(3)5∶4(4)2∶3(5)1∶2(6)3∶3∶2
本题解析:(1)利用物质的量之比等于化学计量数之比,所以(a-13)mol:6mol=1:2,解得a=16,故答案为:16;
(2)反应达平衡时,混合气体为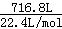 =32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
=32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
(3)由(1)知a=16mol,由(3)b=24mol,
所以故原混合气体为16mol+24mol=40mol,
由(3)知平衡混合气体的组成为:N212 mol,H212 mol,NH3为8 mol.
所以平衡混合气体的物质的量为12mol+12mol+8mol=32mol,
则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=40mol:32mol=5:4,
故答案为:5:4;
(4)由(1)知a=16mol,由(3)b=24mol,所以a:b=16mol:24mol=2:3,
故答案为:2:3;(5)由(3)可知,开始是氢气的物质的量为24mol;
平衡时参加反应的氮气的物质的量为4mol,参加反应的氢气的物质的量为12mol,
所以达到平衡时,N2和H2的转化率之比α(N2):α(H2)=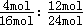 =1:2,
=1:2,
故答案为:1:2.
(6)N2 +3H2  2NH3,
2NH3,
开始(mol):16 b 0
变化(mol):4 12 8
平衡(mol):12 (b-12)8
平衡时,NH3的含量(体积分数)为25%,所以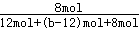 ×100%=25%,解得b=24,
×100%=25%,解得b=24,
所以平衡混合气的组成为:N212 mol,H212 mol,NH3为8 mol,
平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,
故答案为:3:3:2。
点评:本题考查化学平衡的有关计算,难度不大,注意基础知识的掌握与三段式解题法的步骤。
本题难度:一般
5、选择题 下列措施或事实能用勒沙特列原理解释的是(? )
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深
C.钢铁在潮湿的空气中更容易生锈
D.氯气可以用排饱和食盐水的方法收集
参考答案:D
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,这就是勒沙特列原理。合成氨是放热反应,升高温度,平衡向逆反应方向移动,A不正确。B中反应前后体积不变,改变压强平衡不移动,颜色加深是因为容积减小,浓度增大引起的,B不正确。C是电化学腐蚀,不是可逆反应,不正确。氯离子浓度越大,氯气溶解的就越少,所以正确的答案是D。
本题难度:一般