微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8.
(1)请写出元素Y的原子结构示意图:______;其中元素W在周期表中的位置:______.
(2)用电子式表示X与W形成化合物的过程:______.
(3)X、Y、Z、W的原子半径由大到小的顺序为:______.(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的化学方程式:______.
(5)元素X与元素Y相比,金属性较强的是______(用元素符号表示),请举一例实验事实证明这一结论:______.
参考答案:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,则分别位于第ⅠA族、ⅢA族、ⅤA族、ⅧA族,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,则Z为N元素,W、X原子次外层电子数为8,分别为Cl元素、Na元素,则Y为Al元素,
(1)Y为Al元素,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期、ⅢA族,原子结构示意图为:
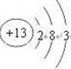
,
故答案为:

;第三周期、ⅢA族;
(2)W、X分别为Cl元素、Na元素,用电子式表示NaCl的形成过程可表示为:
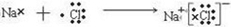
,
故答案为:
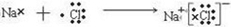
;
(3)X、Y、Z、W分别为:Na、Al、N、Cl,根据同周期元素从左到右原子半径逐渐减小,原子核外电子层数越多半径越大可知:Na>Al>Cl>N,故答案为:Na>Al>Cl>N;
(4)W的单质与X的最高价氧化物对应水化物反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)Na与Al相比较,金属性较强的为Na,可用过与水反应的剧烈程度比较,故答案为:Na;钠与水反应比铝要剧烈.
本题解析:
本题难度:一般
2、简答题 某元素M的原子核内质子数与中子数相等,它形成气态氢化物在标准状况下的密度是1.518g/L,该氢化物0.5mol充分燃烧,生成9g水,则M的元素符号为______,原子序数是______,原子结构示意图为______,M的阴离子电子层结构与______等微粒相同.
参考答案:M形成气态氢化物在标准状况下的密度是1.518g/L,则M的相对分子质量为22.4×1.1518=34,该氢化物0.5mol充分燃烧,生成9g水,即n(H2O)=9g18g/mol=0.5mol,1mol该氢化物含H:2×2×0.5mol=2mol,则1mol氢化物中M的质量为34g-2g=32g,即M的相对原子质量应为32,又M的原子核内质子数与中子数相等,则M的原子序数为16,应为S元素,
原子核外有3个电子层,最外层电子数为6,原子结构示意图为
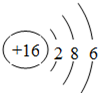
,M的阴离子电子层结构为
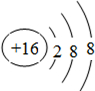
,与M的阴离子电子层结构相同的微粒有等P3-、Cl-、Ar、K+、Ca2+,
故答案为:S;16;

;?P3-、Cl-、Ar、K+、Ca2+(任选一种).
本题解析:
本题难度:一般
3、填空题 A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素.又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题:
(1)D在元素周期表中的位置是______.
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为______.
(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为______;若有1mol电子转移,生成Z的物质的量为______mol.
(4)写出实验室制备BA3的化学方程式______.将BA3通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式______.
(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是______.以石墨为电极,用该电池电解100mL饱和食盐水,一段时间后,在两极共收集到224mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)______.
参考答案:A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,A的原子序数最小,且是主族元素,则A为H元素;A与D为同一主族,D是所在周期原子半径最大的元素,则D为Na元素;C元素的原子核外电子总数是电子层数的4倍,C的原子序数小于11,则C为O元素;四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体,Na是固体,所以B形成的单质为气体,B与C为同一周期,原子序数B<C,则B为N元素.
由分析可知:A为H元素;B为N元素;C为O元素;D为Na元素.
(1)D为Na元素,质子数为11,有3个电子层,最外层有1个电子,处于周期表第三周期第ⅠA族,故答案为:第三周期第ⅠA族;
(2)A为H元素,C为O元素,两元素形成的化合物为H2O、H2O2,H2O2分解生成H2O,所以X是H2O2、Y是H2O,H2O2是共价化合物氧原子与氢原子之间形成1对共用电子对,氧原子与氧原子之间形成1对共用电子对,H2O2的电子式为
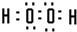
,故答案为:
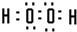
;
(3)Y是H2O,D与C形成的化合物可与Y反应生成单质Z,则D与C形成的化合物是Na2O2,反应方程式为2?Na2O2+2H2O=4NaOH+O2↑;由方程式可知,反应中Na2O2既是氧化剂也是还原剂,物质的量之比为1:1,每生成1molO2转移2mol电子,所以有1mol电子转移,生成O2的物质的量为1mol×12=0.5mol,故答案为:2Na2O2+2H2O=4NaOH+O2↑;0.5;
(4)BA3的是NH3,实验室制取NH3的方程式为2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O,
溴具有强氧化性,NH3通入溴水中可发生反应,生成单质为N2,生成的盐为NH4Br,反应离子方程式为8NH3+3Br2=N2+6NH4++6Br-,
故答案为:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O;8NH3+3Br2=N2+6NH4++6Br-;
(5)B2A4为N2H4,N2H4燃烧生成H2O和N2,以N2H4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.负极发生氧化反应,N2H4在负极放电生成N2和H2O,该电池负极反应是N2H4+4OH--4e-═N2+4H2O.
电解100mL饱和食盐水,一段时间后,在两极共收集到224mL气体为氯气和氢气,混合气体的物质的量为0.224L22.4L/mol=0.01mol,由2NaCl+2H2O?通电?.?2NaOH+Cl2↑+H2↑可知,生成的氯气和氢气的物质的量相等为0.005mol,所以生成的氢氧化钠的物质的量为0.01mol,所以c(OH-)=0.01mol0.1L=0.1mol/L,所以c(H+)=10-1410-1=10-130.1mol/L,所以溶液PH=-log10-13=13,故答案为:N2H4+4OH--4e-═N2+4H2O;13.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.在元素周期表中,元素所在族的族序数等于原子核外最外层电子数
B.在元素周期表中,元素所在的周期数等于原子核外电子数
C.最外层电子数为8的微粒是稀有气体元素的原子
D.同主族元素的原子序数越大,其原子半径越大
参考答案:A、主族元素的族序数等于最外层电子数,但副族元素不一定,如锰处于第ⅦB族,外围电子排布为3d54s1,故A错误;
B、元素所在的周期数等于电子层数(钯除外),故B错误;
C、最外层电子数为8的微粒,若是中性原子则是稀有气体元素的原子,若是离子则不是,如S2-等,故C错误;
D、同主族元素的原子序数越大,电子层越多,电子层的影响比核电荷数大,原子半径增大,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素?③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族.
A.①②
B.①③
C.②④
D.③④
参考答案:C
本题解析:
本题难度:简单