微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式的说 法正确的是

A.配平后的化学计量数依次为3、1、2、6、3
B.若有1 mol的S被氧化,可生成2 molS2-
C.氧化剂与还原剂的物质的量之比为1:2
D.2 mol S参加反应转移3 mol电子
参考答案:B
本题解析:
本题难度:一般
2、选择题 在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为(? )
A.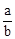 mol·L-1
mol·L-1
B.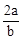 mol·L-1
mol·L-1
C.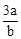 mol·L-1
mol·L-1
D.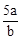 mol·L-1
mol·L-1
参考答案:A
本题解析:往FeBr2溶液中通入Cl2,由于还原性Fe2+>Br -,所以Fe2+ 先被氧化,所以设bLFeBr2溶液的浓度为c,则有:?
2Fe2+ + Cl2 = 2F3++2Cl- ?2Br - + Cl2 = Br2+2Cl-
2 ?:? 1? 2? : 1
bc ?0.5bc? bc? 0.5bc
所以n(Cl2)=bc=amol,所以c=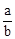 ?mol·L-1 ,故选B。
?mol·L-1 ,故选B。
本题难度:一般
3、选择题 将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上 _____ + ____? →? _______ + _______ + _______+H2O?组成一个未配平的化学方程式,正确的顺序是:
A.FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3、N2O
B.Fe2(SO4)3、N2O;FeSO4、HNO3、Fe(NO3)3
C.HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O
D.HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O
参考答案:D
本题解析:略
本题难度:简单
4、选择题 将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48 L(标准状况),向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全。则下列有关叙述中不正确的是
A.开始加入合金的物质的量之和为0.3mol
B.反应中被还原和未被还原的硝酸物质的量之比为3∶1
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.生成沉淀的质量比原合金的质量增加10.2g
参考答案:B
本题解析:A/在Mg、Cu与硝酸发生反应时金属失去电子变为M2+阳离子,硝酸得到电子变为NO。根据电子守恒可得2n(金属)=3n(NO)=3×0.2=0.6mol/所以金属的物质的量为0.3mol.正确。B.在反应中硝酸的作用有2个,一个是起酸的作用,由于金属的物质的量为0.3mol。金属都是+2价的金属,所以起酸作用的物质的量为0.6mol。起氧化剂作用的硝酸的物质的量为0.2mol。所以反应中被还原和未被还原的硝酸物质的量之比为0.2:0.6= 1:3.错误。C.n(M2+)=0.3mol.发生沉淀反应消耗NaOH的物质的量为0.3mol×2=0.6mol。所以V(NaOH)=0.6mol÷3mol/L=0.2L=200ml.正确。D.生成沉淀的质量比原合金的质量增加的质量就是OH-的质量。发生沉淀反应消耗NaOH的物质的量为0.3mol×2=0.6mol。所以增加的质量为0.6mol×17g/mol=10.2g。正确。
本题难度:一般
5、填空题 XeO3是一种不稳定的物质,具有强氧化性。
(1)配平反应的离子方程式:
_____XeO3+____Mn2+ +_____H2O → ?MnO4-+____Xe↑+___H+
(2)反应现象为:①有气泡产生,②______________________。
(3)发生氧化反应的物质(或微粒)是_______________。
①此时转移电子_____________mol。
②将反应后的溶液稀释至90mL,所得溶液的pH=________。
参考答案:(1)5,6,9,6,5,18(2分)
(2)溶液显紫红色(1分)
(3)Mn2+(1分)
(4)0.015? pH =" 1" (各2分,共4分)
本题解析:略
本题难度:一般