微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据等电子原理判断,下列说法中错误的是
A.B3N3H6分子中所有原子均在同一平面上
B.子中存在双键,可发生加成反应
C.H3O+和NH3是等电子体,均为三角锥形
D.CH4和NH4+是等电子体,均为正四面体
参考答案:B
本题解析:电子数和原子数分布都相等的分子是等电子体。B3N3H6和苯是等电子体,由于苯分子中不存在碳碳双键,所以选项B是错误的,其余都是正确的,答案选B。
本题难度:一般
2、选择题 下列各图所表示的反应是吸热反应的是( )
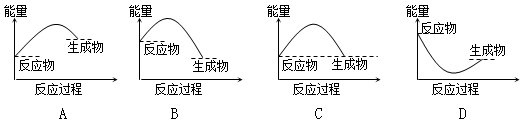
参考答案:A
本题解析:
试题解析:从能量的角度分析吸热反应,即反应物的总能量低于生成物的总能量,故A正确。
考点:焓变与反应吸热、放热的关系
本题难度:一般
3、选择题 下列物质中既含有共价键又含有离子键的是
A.HF
B.NaCl
C.HCl
D.K2SO4
参考答案:D
本题解析:离子键一般存在于金属元素或铵根离子中,共价键存在于非金属元素之间。A选项极性共价键B选项离子键,C选项极性共价键。D选项既有离子键又有共价键。所以答案选D
本题难度:一般
4、选择题 在一密闭容器中有如下反应:L (s) + a G (g)? ?b R (g) 温度和压强对该反应的影响如图所示,其中压强P1 < P2,由此可判断
?b R (g) 温度和压强对该反应的影响如图所示,其中压强P1 < P2,由此可判断
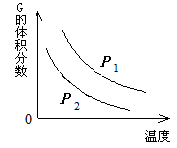
A.正反应为放热反应
B.化学方程式中的计量数a > b
C.G的转化率随温度升高而减小
D.增大压强,容器内气体质量不变
参考答案:B
本题解析:根据图像可知,随着温度的升高,G的体积分数逐渐减小,说明升高温度平衡向正反应方向移动,G的转化率增大,因此正反应是吸热反应,A、C不正确。当温度相同时,压强越大,G的体积分数越小,说明增大压强平衡向正反应方向移动,即正反应是体积减小的,所以a大于b。由于L是固体,向正反应方向移动时,气体的质量是增加的,所以D不正确,B正确,答案选B。
本题难度:一般
5、选择题 化学键的断裂和形成的观点不能用于解释下列化学事实中的( )
A.氧化还原反应
B.化学反应的能量变化
C.加成反应
D.化学反应过程的本质
参考答案:A、有电子转移的反应是氧化还原反应,所以不能用化学键的断裂和形成的观点解释,故A符合;
B、断裂化学键需要吸收能量,形成化学键放出能量,所以有化学反应的能力变化就一定有化学键的断裂和形成,所以可用化学键的断裂和形成的观点解释,故B不符合;
C、有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,所以加成反应可用化学键的断裂和形成的观点解释,故C不符合;
D、化学反应的本质是:旧化学键的断裂和新化学键的形成,只要有旧化学键的断裂和新化学键的形成就一定发生化学反应,所以可用化学键的断裂和形成的观点解释,故D不符合;
故选A.
本题解析:
本题难度:简单