微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 婴儿用的一次性尿布中有一层能吸水、保水的物质,也有人建议可用此物质对沙漠进行治理。下列高分子中有可能被采用的有(?)
A.
B.
C.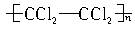
D.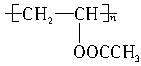
参考答案:B
本题解析:羟基为亲水基,与水分子易形成氢键,故含有羟基的高分子有可能被采用。
本题难度:一般
2、简答题 硅是带来人类文明的重要元素之一.硅及其化合物在材料、电子信息等方面具有重要运用.回答下列问题:
(1)将下列硅酸盐改写成氧化物的形式(改写时注意金属氧化物在前.非金属氧化物在后,低价在前,高价在后,H2O一般写在最后).
①镁橄榄石(Mg2SiO4):______.
②高岭土[Al2(Si2O3)(OH)4]:______.
(2)玻璃是硅酸盐,工业上用石灰石、纯碱、石英在玻璃熔炉中熔融制得,写出相应的化学方程式______,______.实验室盛放烧碱溶液的试剂瓶的瓶塞不能用玻璃塞,而用橡皮塞.其原因为(用化学方程式表示)______.
(3)工业上用碳在高温下与二氧化硅制取粗硅,写出该反应的方程式______.
参考答案:(1)把硅酸盐写成二氧化硅和其它氧化物形式,要保证原子总数和化合价不变,按化合价分别写化学式分别为2MgO?SiO2、Al2O3?2SiO2?2H2O,故答案为:①2MgO?SiO2 ②Al2O3?2SiO2?2H2O;
(2)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,该反应的化学方程式为:Na2CO3+SiO2 高温.Na2SiO3+CO2↑,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2高温.CaSiO3+CO2↑,因为玻璃中的SiO2能与NaOH反应,方程式为:SiO2+2NaOH═Na2SiO3+H2O;
故答案为:SiO2+CaCO3═CaSiO3+CO2↑、SiO2+Na2CO3═Na2SiO3+CO2↑,SiO2+2NaOH═Na2SiO3+H2O.
(3)碳在高温下与二氧化硅反应生成粗硅和CO,故反应方程为:SiO2+2C═Si+2CO↑;
故答案为:SiO2+2C═Si+2CO↑.
本题解析:
本题难度:简单
3、实验题 (16分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,该水解反应的化学方程式为?。再经过滤、水洗除去其中的Cl–,再烘干、焙烧除去水分得到粉体TiO2。检验TiO2·xH2O中Cl–是否被除净的方法是?。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是?;
②滴定终点的现象是?。
③滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为?。
④下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果?。
若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果?。
参考答案:(1) TiCl4+(2+x) H2O TiO2·xH2O↓+4HCl(3分)
TiO2·xH2O↓+4HCl(3分)
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。(2分)
(2)①抑制 NH4Fe(SO4)2水解(2分)?②溶液变成红色(2分)
③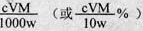 ?(3分)?④偏高(2分)?偏低(2分)
?(3分)?④偏高(2分)?偏低(2分)
本题解析:
⑴水解反应的化学方程式TiCl4+(2+x) H2O TiO2·xH2O↓+4HCl,注意含不定项系数的方程的配平。检验Cl―的方法,取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。⑵①加入一定量H2SO4的原因:NH4+和Fe2+都能发生水解,溶液呈酸性,加H2SO4提高H2SO4的浓度,抑制 NH4Fe(SO4)2水解。②滴定终点的现象是溶液变成红色
TiO2·xH2O↓+4HCl,注意含不定项系数的方程的配平。检验Cl―的方法,取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。⑵①加入一定量H2SO4的原因:NH4+和Fe2+都能发生水解,溶液呈酸性,加H2SO4提高H2SO4的浓度,抑制 NH4Fe(SO4)2水解。②滴定终点的现象是溶液变成红色
③ω(TiO2)= ④NH4Fe(SO4)2溶液有少量溅出,使读出的V增大,测定结果偏高;若在滴定终点读取滴定管刻度时,俯视标准液液面,读出的体积变化量偏小,即V值偏小,使测定结果偏低。
④NH4Fe(SO4)2溶液有少量溅出,使读出的V增大,测定结果偏高;若在滴定终点读取滴定管刻度时,俯视标准液液面,读出的体积变化量偏小,即V值偏小,使测定结果偏低。
本题难度:一般
4、填空题 (15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) 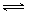 ?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1
?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) 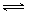 ?H2NCOONH4(氨基甲酸铵) (l)?△H1
?H2NCOONH4(氨基甲酸铵) (l)?△H1
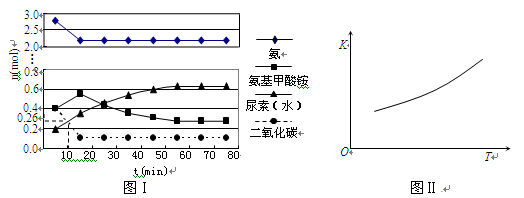
第二步:H2NCOONH4(l) 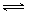 ?H2O(l)+H2NCONH2(l)?△H2
?H2O(l)+H2NCONH2(l)?△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
参考答案:15分)⑴B?
⑵①2? 55?②0.148 mol/(L·min)? ③>
(每空3分,共15分)
本题解析:(1)由方程式2NH3(l)+CO2(g) 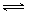 ?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1,可知正反应方向为气体体积减少的方向,在高压条件下,平衡将正反应方向移动,从而提高尿素的产率
?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1,可知正反应方向为气体体积减少的方向,在高压条件下,平衡将正反应方向移动,从而提高尿素的产率
(2)①合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) 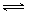 ?H2NCOONH4(氨基甲酸铵) (l)?△H1
?H2NCOONH4(氨基甲酸铵) (l)?△H1
第二步:H2NCOONH4(l) 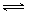 ?H2O(l)+H2NCONH2(l)?△H2;
?H2O(l)+H2NCONH2(l)?△H2;
从图形分析,第一步反应达平衡时时间更短,第二步反应达平衡时间更长,所以,合成尿素总反应的快慢由第二步决定;总反应进行到55min时到达平衡。
②v(CO2)=0.148 mol/(L·min);
③由图II可得,△H2>0;
本题难度:一般
5、选择题 海洋是一个巨大的宝藏。下列物质不经过化学变化就能从海水中获得的是(?)
A.单质溴
B.单质镁
C.氯化钠
D.烧碱
参考答案::C
本题解析:海水中提取食盐原理是蒸发结晶,不涉及化学变化。故选C。
AB海水中提取溴、镁都是从化合物转化为单质,必然有化学变化。不符合题意。
D、烧碱(氢氧化钠)不从海水里面提取。它是氯碱工业的产品。
点评:了解典型化工生产原理。
本题难度:简单