微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)如何防止铁的腐蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
序号
| 内容
| 实验现象
|
1
| 常温下将铁丝放在干燥空气中一个月
| 干燥的铁丝表面依然光亮
|
2
| 常温下将铁丝放在潮湿空气中一小时
| 铁丝表面依然光亮
|
3
| 常温下将铁丝放在潮湿空气中一个月
| 铁丝表面已变得灰暗
|
4
| 将潮湿的铁丝放在常温的氧气流中一小时
| 铁丝表面略显灰暗
|
5
| 将潮湿的铁丝放在高于常温的氧气流中一小时
| 铁丝表面已变得灰暗
|
6
| 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时
| 铁丝表面灰暗程度比实验5严重
|
回答以下问题:
⑴上述实验中发生了电化学腐蚀的是(填实验序号)?,在电化学腐蚀中,负极反应是_______________?,正极反应是_______________??。
⑵由该实验可知,可以影响铁锈蚀速率的因素是?。
⑶下列对金属制品采取的防护方法不正确的是?(填序号)。
A.在电线的外面包上一层塑料层?
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
参考答案:⑴3、4、5、6?(4分)Fe-2e-=Fe2+(或2Fe-4e-=2Fe2+),2H2O+O2+4e-=4OH- (4分)
⑵湿度、温度、O2的浓度、电解质溶液(4分)?⑶C(2分)
本题解析:(1)在潮湿的环境中,不纯的金属或合金容易发生电化学腐蚀。所以根据实验中的环境和实验现象可知,发生电化学腐蚀的是3、4、5、6。铁属于活泼的金属,在电化学腐蚀中,铁是负极,失去电子,发生氧化反应,电极反应式为Fe-2e- Fe2+。由于溶液的酸性很弱,所以主要是吸氧腐蚀,因此正极反应式为2H2O+O2+4e-=4OH-。
Fe2+。由于溶液的酸性很弱,所以主要是吸氧腐蚀,因此正极反应式为2H2O+O2+4e-=4OH-。
(2)根据实验中的环境和实验现象可知,影响铁锈蚀速率的因素有湿度、温度、O2的浓度、电解质溶液等。
(3)由于铁的活泼性强于铜,所以如果在海轮的铁制外壳上焊上铜块,则此时铁是负极,加速腐蚀,C是不正确的,AB正确,答案选C。
本题难度:一般
2、选择题 利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是
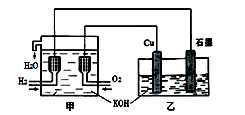
A.乙中Cu电极的电极反应式是:
2Cu + 2OH-→ Cu2O+ H2O+ 2e-
B.甲中通入氢气的电极为正极
C.乙中阴离子向石墨电极移动
D.电路上通过0.5 mol电子,可制得0.5 mol Cu2O
参考答案:A
本题解析:甲装置为燃料电池装置,其中通入氢气的一极为负极,通入氧气的一极为正极;乙装置为电解池,铜片与正极相连为阳极,石墨为阴极;所以
A正确,乙中Cu电极的电极反应式为2Cu + 2OH-→ Cu2O+ H2O+ 2e-
B错,甲中通入氢气的电极为负极;
C错,乙中阴离子向铜电极(阳极)移动;
D错,电路上通过0.5 mol电子,可制得0.25 mol Cu2O
本题难度:简单
3、选择题 下图中a、b是惰性电极,通电2 min后b电极附近溶液呈红色,b电极生成标准状况时的气体体积为2.24L,NaCl溶液体积为500 mL,下列说法不正确的是
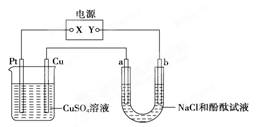
A.电解过程中CuSO4溶液物质的量浓度不变
B.电子流动的方向是由a流向Cu电极
C.电路中通过的电子为0.2mol,
D.电解速率v(OH-)=0.2mol/(L.min)
参考答案:A
本题解析:通电2 min后b电极附近溶液呈红色,说明b电极周围生成OH-,所以b是阴极,生成的气体是氢气,物质的量是0.1mol,转移电子是0.2mol,生成氢氧化钠是0.2mol,所以氢氧化钠的浓度是0.4mol/L,即电解速率v(OH-)=0.4mol/L÷2min=0.2mol/(L.min)。Y是电源的负极,X是正极,Pt是阳极,铜电极是阴极。A不正确,溶液中铜离子和OH-分别放电,浓度减小,其余都是正确的,答案选A。
本题难度:一般
4、选择题 下列有关物质的性质和该性质的应用均正确的是?(?)
A.常温下浓硫酸与铝不发生反应,可在常温下用铝制容器贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有氧化性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
参考答案:C
本题解析:常温下浓硫酸与铝不是不发生反应,而是发生了钝化,A选项不正确;二氧化硅可与氢氟酸反应,B选项不正确;C1O2中Cl为+4价,不稳定,易被还原为Cl-,因此可利用其氧化性给自来水杀菌消毒,C选项正确;在海轮外壳上装若干铜块形成了原电池时铁做了负极加快了铁的腐蚀,D选项不正确。
本题难度:一般
5、选择题 如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
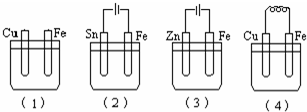
A.(4)(3)(2)(1)
B.(4)(3)(1)(2)
C.(3)(4)(1)(2)
D.(4)(3)(1)(2)
参考答案:根据图知,①是化学腐蚀,金属铁被腐蚀,④装置是原电池,金属铁做负极,做负极的腐蚀速率快,②③装置是电解池,其中②金属铁为阴极,被保护,③中金属铁为阳极,受到腐蚀,金属腐蚀的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,所以腐蚀速率是③④①②,
故选C.
本题解析:
本题难度:简单