微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 金属具有良好的导电、导热及延展性等,因此广泛应用于制造各种材料.请回答下列问题:
(1)家庭中“钢精锅”是由铝合金做成的,它能长期使用的原因是:______.
(2)下列关于铁制品保护措施的说法中不正确的有______(填序号).
①在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
②相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
③在海轮的外壳上常焊有锌块,且定期更新
④将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理.
参考答案:(1)铝是亲氧元素,在空气中极易和氧气反应生成的氧化铝保护膜,阻止了铝的进一步反应,从而达到保护的目的.
故答案为:致密的氧化物保护膜.?
(2)①在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油,铬性质不活泼,机油或黄油不溶于水,所以能阻止金属被腐蚀,故正确.
②相同条件下,马口铁(表层镀锡)中铁比锡活泼,铁和锡形成的原电池中,铁较易腐蚀;白铁(表层镀锌)中锌较活泼,锌和铁形成的原电池中锌作负极,从而保护了铁,所以白铁皮更为耐用,故错误.
③在海轮的外壳上常焊有锌块,且定期更新,锌和铁形成的原电池中锌作负极,从而保护了铁,故正确.
④将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理,阻止了铁和其它物质反应从而保护了铁,故正确.
故选②.
本题解析:
本题难度:一般
2、填空题 如图甲、乙是电化学实验装置。
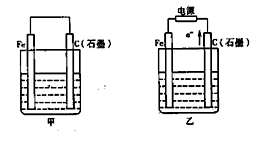
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为??;
②乙中总反应的离子方程式为??;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为??。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为??;
②乙中Fe电极是?(填阳极或阴极),总反应式是??,
电解一段时间后溶液PH将?(填增大、减小或不变)
参考答案:(1)①O2+4e-+2H2O=4OH-?②? 2Cl-+2H2O=Cl2↑+H2↑+2OH-③5 Cl2+I2+6H2O=10HCl+2HIO3
(2)① Fe-2e-=Fe2+?②阴极,2CuSO4+2H2O=2Cu+O2↑+2H2SO4;减小
本题解析:(1)甲为铁的吸氧腐蚀:正极:O2+4e-+2H2O=4OH-?负极:Fe-2e-=Fe2+
乙是电解食盐水:2Cl-+2H2O=Cl2↑+H2↑+2OH-
(2)甲为原电池,铁为负极: Fe-2e-=Fe2+;
乙为电解硫酸铜的电解池;铁为阴极,总反应为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4
本题难度:一般
3、选择题 钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法正确的是( )
A.钢铁设备上连接铜块可以防止腐蚀
B.原电池的正极反应为:O2+2H20+4e-═40H-
C.原电池的负极反应为:Fe→Fe3++3e-
D.钢铁与外加直流电源的正极相连可以防止腐蚀
参考答案:A.铁、铜相连和合适的电解质溶液能构成原电池,铁作负极,负极上铁易失电子而被腐蚀,故A错误;
B.钢铁在潮湿的空气中形成原电池,铁作负极,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:O2+2H20+4e-═40H-,故B正确;
C.原电池的负极反应为:Fe→Fe2++2e-,故C错误;
D.钢铁与外加直流电源的正极时作阳极,阳极上铁失电子生成亚铁离子而被腐蚀,故D错误;
故选B.
本题解析:
本题难度:一般
4、选择题 相同材质的铁在图中四种情况下最不易被腐蚀的是
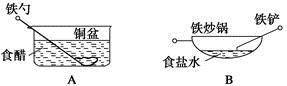

参考答案:C
本题解析:在A中,能构成原电池,铁作负极,易被腐蚀;在B中,食盐水提供电解质溶液环境,铁炒锅和铁铲都是铁碳合金,符合原电池形成的条件,铁作负极,碳作正极,铁易被腐蚀;在C中,铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀;在D中,酸雨提供电解质溶液环境,铁铆钉和铜板分别作负、正极,形成原电池,铁易被腐蚀。答案选C。
本题难度:一般
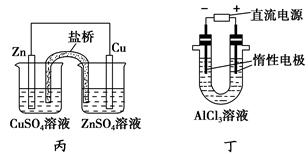
5、选择题 下列说法正确的是?( )。
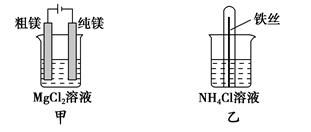
A.用甲装置电解精炼镁
B.用乙装置验证试管中铁丝发生析氢腐蚀
C.用丙装置构成铜锌原电池
D.用丁装置利用电冶金法制铝
参考答案:B
本题解析:Mg2+和Al3+在溶液中不放电,选项A和D错。丙装置中两种电解液互换才能构成铜锌原电池,C错。
本题难度:一般