| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《原电池原理》试题特训(2017年最新版)(八)
(3)如果把稀硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: ____________。 参考答案:(1) C,D?(2) 2.24?(3)Cu2+ +2e-=Cu 本题解析:(1)铜、锌通过导线连接,置于硫酸中,则构成原电池。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,溶液中的氢离子在正极得到电子,被还原,发生还原反应,生成氢气。纯锌片换成含有杂质的锌,则锌和杂质将构成原电池,电子直接在锌片表面被氢离子得到,即流向铜片的电子减少,所以铜片上产生气泡的速率变慢。 本题难度:一般 2、填空题 (12分)下图是一个化学过程的示意图。 |
参考答案:(1)电解或电解池
(2)阳极
(3)CH3OH+8OH--6 e- CO32-+6H2O
(4)4Ag++2H2O 4Ag+O2↑+4H+
4Ag+O2↑+4H+
(5)280 BD
本题解析:(1)由图可知甲池能自发发生氧化还原反应,是燃料电池,乙、丙都是电解池装置;
(2)甲池通入甲醇的一极是负极,氧气一极是正极,d与负极相连,所以d是阴极,则c是阳极;
(3)通入甲醇的一极是负极发生氧化反应,失去电子生成二氧化碳,二氧化碳与电解质溶液反应,最终生成碳酸根离子和水,电极反应式为CH3OH+8OH--6 e- CO32-+6H2O;
(4)乙是电解硝酸银溶液,A是阳极,B是阴极,所以阳极产生氧气,阴极产生Ag,离子方程式为4Ag++2H2O 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
(5)乙中B增加的质量是析出的Ag的质量,所以析出5.4gAg时转移电子的物质的量是5.4g/108g/mol=0.05mol,根据反应O2+4e-+2H2O=4OH-,可知甲池中理论消耗氧气得物质的量是0.05/4mol,标准状况下的体积是0.05/4mol×22.4L/mol=0.28L=280mL;丙池析出金属0.64g,丙池转移电子的物质的量也是0.05mol,若该金属是+1价,则该金属的相对原子质量是1.6/0.05=32,若该金属是+2价金属,则该金属的相对原子质量是1.6/0.05/2=64,所以答案选B。
考点:考查原电池、电解池的判断,电化学原理的应用
本题难度:一般
3、选择题 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是?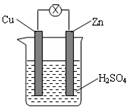
A.该装置将化学能转变为电能
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.锌片发生还原反应
参考答案:A
本题解析:略
本题难度:简单
4、选择题 某原电池总反应离子方程式为2Fe3++Fe===3Fe2+,能实现该反应的原电池是(? )
A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
参考答案:B
本题解析:由离子方程式为2Fe3++Fe===3Fe2+可知:若该反应设计为原电池,则负极材料是Fe,正极的活动性比Fe弱,电解质溶液为含有Fe3+的溶液。根据上述分析,对各个选项逐一排查,可得选项为B。
本题难度:简单
5、选择题 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述正确的是
A.放电时Zn是正极
B.放电时负极反应为:Zn-2e- +2OH- = Zn(OH)2
C.充电时Fe(OH)3被还原
D.充电时电解液的碱性增强
参考答案:B
本题解析:A、放电时,Zn失去电子,发生氧化反应,所以作负极,错误;B、根据总的反应方程式,可知放电时负极发生的反应是Zn-2e- +2OH- = Zn(OH)2,正确;C、充电时,Fe元素的化合价从+3价升高到+6价,被氧化,错误;D、充电时,溶液由碱性变为中性,则溶液的碱性减弱,错误,答案选B。
考点:考查电化学反应原理的判断
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《反应速率与.. | |