微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
请回答下列问题:
(1)上述正反应方向是?反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)。
t1℃时物质浓度(mol/L)的变化
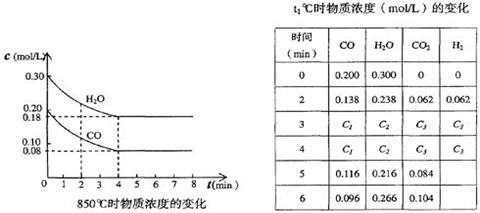
时?间(min)
| CO
| H2O
| CO2
| H2
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| C1
| C2
| C3
| C3
|
4
| C1
| C2
| C3
| C3
|
5
| 0.116
| 0.216
| 0.084
| ?
|
6
| 0.096
| 0.266
| 0.104
| ?
|
(3) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气? B.降低温度? C.使用催化剂? D.增加氢气浓度
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:?。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为?。
(6) 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g)?△H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g)?△H = -534.0 kJ·mol-1
NO2(g) 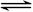 1/2N2O4(g)?△H = -26.35 kJ·mol-1
1/2N2O4(g)?△H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
________________________________________________________。
参考答案:(1)放热?(2分)(2)0.03 (2分)?
(3)①平衡?大于(每空1分)?② D? A(每空1分)
(4)75%?(2分)?(5)Y=X(2分)
(6)2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g)?△H = -1083.0 kJ·mol-1(3分)
本题解析:(1)根据表中数据可知,随着温度的升高,平衡常数逐渐减小,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应。
(2)根据图像可知,在0~4 minCO的浓度减少了0.2mol/L-0.08mol/L=0.12mol/L,所以反应速率是0.12mol/L÷4min=0.03mol/(L·min)。
(3)①在3 min~4 min之间,物质的浓度不再发生变化,所以反应达到平衡状态。由于正反应是放热反应,所以升高温度,平衡向逆反应方向移动,因此平衡时C1大于0.08 mol/L。
②增大水蒸气的浓度或降低温度平衡都向正反应方向移动,催化剂不能影响平衡状态,增大氢气浓度平衡向逆反应方向移动,D正确;5min~6min时,CO的浓度降低,水蒸气和氢气的浓度增大,所以平衡向正反应方向移动,因此改变的条件是增大水蒸气的浓度,答案选A。
(4)? CO(g) + H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始量(mol)?(5-5X)? 5X? 0? 0
转化量(mol)?(5-5X)Y (5-5X)Y?(5-5X)Y (5-5X)Y
平衡量(mol)(5-5X-5Y+5XY)(5X-5Y+5XY)?(5-5X)Y (5-5X)Y
所以有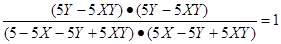
解得Y=X
所以CO的转化率是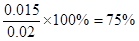
(5)? CO(g) + H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始浓度(mol/L)? 0.020? 0.020? 0? 0
转化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)? 0.02-x? 0.02-x? x? x
(6)考查盖斯定律的应用。根据已知反应可知,②×2-①-③×2即得到2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g) ,所以反应热△H=-534.0 kJ·mol-1×2-67.7 kJ·mol-1+26.35 kJ·mol-1×2=-1083.0 kJ·mol-1。
本题难度:一般
2、选择题 铜锌原电池(如图所示)工作时,下列叙述正确的是

[? ]
A.正极反应为:Zn-2e-=Zn2+
B.电池反应为:Zn+Cu2+=Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
参考答案:BC
本题解析:
本题难度:一般
3、填空题 人们应用原电池原理制作了多种电池,以满足不同的需要。在现代生活、生产和科学技术的发展中,电池发挥着越来越重 要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
(1)(6分)电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为Ag2O和Zn,电解液为KOH溶液。工作时电池总反应为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。
①工作时电流从 ??极流向 ?极(两空均选填“Ag2O”或“Zn”)。
②电极反应式为:正极?,负极?。
(2)(4分)蓄电池在放电时起原电池作用,在充电时起电解池的作用。爱迪生蓄电池分别在充电和放电时发生的反应 为:
为:
①放电时,正极为?。正极的电极反应式为?。
②该蓄电池中的电解质溶液应为?(选填“酸性”或“碱性”)溶液。
参考答案:(1)①电子从Zn流向Ag2O,电流流向则相反;
②正极:Ag2 O+2e-+H2O=2Ag+2OH-,负极:Zn-2e-+2 OH-= Zn(OH)2;
O+2e-+H2O=2Ag+2OH-,负极:Zn-2e-+2 OH-= Zn(OH)2;
(2)正极为NiO2,NiO2+2e-+2H2O=Ni(OH)2+2OH-;②碱性
本题解析:略
本题难度:简单
4、选择题 由铝,铁,铜,银和稀硫酸,可以组成原电池的总数为
A.3种
B.4种
C.5种
D.6种
参考答案:C
本题解析:构原电池的条件为:1、要有两个活动性不的材料作电极;2、要有电解质溶液;3、要形成闭合回路;4、能自发进行氧化还原反应;所以组成的原电池的组合有:1、铝,铁;2、铝,铜;3、铝,银;4、,铁,铜,5、铁,银;共有五组可能的情况;
本题难度:一般
5、选择题 下列有关电化学装置完全正确的是( )
A.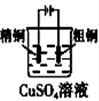
铜的精炼
B.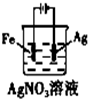
铁上镀银
C.
防止铁被腐蚀
D.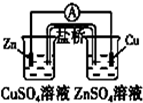
构成铜锌原电池
参考答案:A.粗铜精炼时,粗铜作阳极,纯铜作阴极,且电解质溶液是可溶性的铜盐,故A错误;
B.电镀时,镀层作阳极,镀件作阴极,在铁上镀银时,银作阳极,铁作阴极,故B错误;
C.利用外接电源的阴极保护法保护金属时,被保护的金属作阴极,所以铁作电解池的阴极,故C正确;
D.含有盐桥的原电池中,电极材料和电解质溶液中金属阳离子属于同一元素,铜锌原电池中,硫酸铜溶液中电极应该是铜电极,硫酸锌溶液中电极应该是锌电极,故D错误;
故选C.
本题解析:
本题难度:一般