微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 .常温下,向20?mL?0.2?mol/L?H2A溶液中滴加0.2?mol/L ?NaOH溶液。有关微粒的物质的量变化如图(其中I代表 ?H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是?
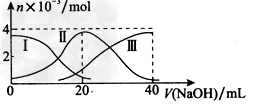
[? ]
A.当V(?NaOH)=20?mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)?
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 ?
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱 ?
D.向NaHA溶液加入水的过程中,pH可能增大也可能减小
参考答案:A
本题解析:
本题难度:一般
2、选择题 盐类水解程度的大小可用“水解度”来表示,NaA型盐的水解度为已水解的离子的物质的量占该离子原来总物质的量的百分数.用0.040mol?L-1NaOH溶液10.0mL与0.020mol?L-1的某一元弱酸HA20.0mL恰好完全中和,所得溶液pH值为10.则所得NaA溶液的水解度为( )
A.0.25%
B.0.50%
C.0.75%
D.1.0%
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是?
[? ]
A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<?c(NH4Cl)
B.中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3
C.0.2?mol·L-1?HCl溶液与等体积0.05?mol·L-1?Ba(OH)2溶液混合后,溶液的pH=1
D.已知难溶物FeS的Ksp?=?8.1×10-17,FeS饱和溶液中c(H+)2·c(S2-)?=?1.0×10-22,为使溶液里c(Fe2+)达到了1mol/L,应调节溶液中的c(H+)为1.11×10-3mol/L
参考答案:D
本题解析:
本题难度:一般
4、填空题 25℃时,有浓度均为0. 10 mol/L的两种溶液:①NaCl溶液、②CH3COONa溶液。请回答:
(1)两种溶液中,pH>7的是___(填“①”或“②”),其原因是___ (用离子方程式表示)。
(2)下列说法正确的是____(填序号)。
①CH3COONa是弱电解质
②NaCl和CH3COONa都能促进水的电离
③两种溶液等体积混合后,溶液中离子浓度大小关系为:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+)
(3)若电解1.00 L饱和NaCl溶液,收集到1.12 L H2(标准状况),则此时溶液的pH为 ____(不考虑溶液体积的变化)。
参考答案:(1)②; CH3COO- +H2O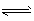 CH3COOH+OH-
CH3COOH+OH-
(2)③
(3)13
本题解析:
本题难度:一般
5、选择题 下列说法不正确的是
?[?]
A.100℃时,纯水中c(H+)=1×10-6 mol·L-1,pH小于7,此时纯水显酸性
B.25℃时,pH=12的烧碱和氢氧化钡溶液,二者物质的量浓度之比为2:1
C.25℃时,pH=3的盐酸与pH=5的硫酸等体积混合,混合液pH等于4
D.25℃时,0.1 mol·L-1 CH3COOH溶液中,c(CH3COOH)>c(CH3COO-)
参考答案:AC
本题解析:
本题难度:一般