微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学实验操作合理的是( )
①在配铜FeSO4溶液时常向其中加入一定量铁粉和稀硫酸
②配制100mL?1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g?NaCl固体.
③物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
④用试管夹从试管底由下往上夹住距试管口约
处,手持试管夹长柄末端,进行加热
⑤不慎将浓硫酸沾在皮肤上,立即用NaHCO3溶液冲洗
⑥用广泛pH试纸测得某溶液的pH=12.3
⑦用碱式滴定管量取20.00mL?0.100?0mol/L?KMnO4溶液
⑧铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜.
A.④⑤⑥⑦
B.①④⑤⑦
C.②③⑥⑧
D.①③④⑧
参考答案:①为防止亚铁离子被氧化和亚铁离子水解,配制溶液中加入铁粉防止亚铁离子被氧化,加入稀硫酸防止亚铁离子水解浑浊,故①正确;
②托盘天平只能精确到0.1g,故②错误;
③量筒是量取一定体积液体的量具,物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行,不能用来溶解物质,故③正确;
④用试管夹从试管底由下往上夹住距试管口约13处,手持试管夹长柄末端,进行加热,故④正确;
⑤不慎将浓硫酸沾在皮肤上,应先干布擦掉,再水冲洗,最后涂碳酸氢钠溶液,立即用NaHCO3溶液冲洗反应放热灼伤皮肤,故⑤错误;
⑥广泛pH试纸只能测定到整数值,故⑥错误;
⑦高锰酸钾溶液具有强氧化性能氧化橡胶管,应用酸式滴定管盛放量取,故⑦错误;
⑧铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜,可以避免污染气体二氧化硫的生成,故⑧正确;
综上所述①③④⑧正确;
故选D.
本题解析:
本题难度:一般
2、选择题 向某NaOH溶液中通入CO2气体后得溶液M。因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸并轻轻振荡,理论上产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且图乙、丙、丁 中分别有OA<OB、OA=AB、OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)
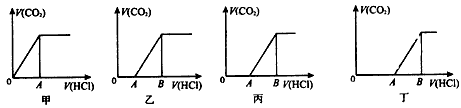
[? ]
A.M中只有一种溶质的有甲和丙
B.M中有两种溶质的有乙和丁
C.M中一定存在:c(Na+)- 2c(CO32-)=c(HCO3-)+c(OH-)-c(H+)
D.乙图显示M中c(NaHCO3)>c(Na2CO3)
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列说法中,正确的是?
[? ]
A.0.1?mol/L醋酸钙溶液中,c(Ca2+ )>c(CH3COO-)> c(OH-)>c(H+) ?
B.体积相同、pH相同的NH4?Cl溶液和盐酸,完全溶解少量且等量的锌粉,前者用时少?
C.将nmol?H2(g)、nmol?I2?(g)和2n?mol?H2?(g)、2n?mol?I2?(g)?分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 ?
D.某物质的溶液中由水电离出的c(H+)=1×10-a?mol·L-1,若a>7时,则该溶液的pH一定为14-a
参考答案:B
本题解析:
本题难度:一般
4、填空题 25℃时,如果取0.1mol?L-1HA溶液与0.1mol?L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因______(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)______0.1mol?L-1NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的计算结果(填具体数字):c(HA)+c(A-)=______mol?L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7?(填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3?B.NH4A?C.(NH4)2SO4?D.NH4Cl
按pH由大到小的顺序排列______(填序号)
参考答案:(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O=HA+OH-.
故答案为:A-+H2O=HA+OH-.
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol?L-1NaOH溶液中由水电离出的c(H+).
故答案为:>.
(3)将酸和碱等体积混合后,溶液的体积扩大一倍,浓度缩小为原来的一半,所以根据物料守恒得,12×0.1mol/L=0.05mol/L.
故答案为:0.05.
(4)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7.
故答案为:>.
(5)(NH4)2SO4?和NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中铵根离子浓度越大,水解程度越小,但水解的个数多,所以氯化铵溶液的pH值大于硫酸铵;
NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵;?
NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性,所以溶液的pH值最大.
故答案为:A>B>D>C.
本题解析:
本题难度:简单
5、选择题 关于浓度均为0.1 mol/L的三种溶液: ①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
[? ]
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)<c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
参考答案:BC
本题解析:
本题难度:一般