微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列对沉淀溶解平衡的描述正确的是
[?]
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
选项
| 实验操作
| 实验目的或结论
|
A
| 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
| 说明该钾盐是K2CO3
|
B
| 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
| 除去MgCl2溶液中少量FeCl3
|
C
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
| 说明常温下Ksp(BaCO3)<Ksp(BaSO4)
|
D
| C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液
| 检验制得气体是否为乙烯
|
参考答案:B
本题解析:A、某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该钾盐可能含CO32-、HCO3-,故A错误;B、向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,Fe3+发生水解反应:Fe3++3H2O?Fe(OH)3+3H+,足量Mg(OH)2消耗H+促进Fe3+水解,使Fe3+完全水解成Fe(OH)3过滤除去,故B正确;C、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓CO32-转化BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故C错误;D、C2H5OH与制得的乙烯都有还原性,通入酸性KMnO4溶液都会褪色,故D错误。
考点:本题考查实验方案的设计与分析。
本题难度:一般
3、实验题 菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下:
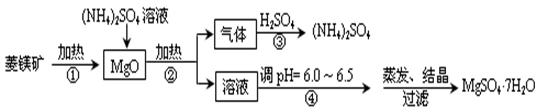
已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
?
| Fe3+
| Al3+
| Mg2+
|
开始沉淀
| 2.1
| 3.7
| 9.0
|
沉淀完全
| 3.2
| 5.2
| 12.4
|
②MgSO4·7H2O在70~80℃时失去3个结晶水,300℃时失去全部的结晶水;
(1)用平衡原理解释:菱镁矿粉粹后加热生成的氧化镁可以溶解在硫酸铵溶液中的原因 ?。
(2)在该工业流程中,可以循环使用的物质是?。
(3)步骤③中氨气和硫酸恰好完全反应,取此时所得的溶液10.00mL配成250mL溶液,配制溶液过程中除烧杯、玻璃棒、胶头滴管、酸式滴定管外,还需要的玻璃仪器有:?;经检测所配制的溶液pH=1,c(SO42ˉ)=1.05mol/L,试求算所配制溶液中NH4+ 水解的平衡常数K(写计算过程,计算结果保留三位有效数字)。
(4)在加热条件下杂质中的三氧化二铁溶于硫酸铵的离子反应方程式是:
?。
(5)蒸发结晶过程中需要使用60~70℃水浴加热方式,其原因是?。
参考答案:(16分)
(1)因NH4++H2O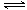 NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
(2)(NH4)2SO4(2分)
(3)250ml容量瓶(2分,没有规格不给分)? K=5.00×10-3 mol?Lˉ1(计算过程见解析)
(4)Fe2O3+ 6NH4+?=6NH3↑+2Fe3++3H2O(条件:加热)(没有写条件和气体呼号扣1分,没配平扣1分;共2分)
(5)避免加热蒸发过程中MgSO4·7H2O失去部分或全部的结晶水(2分)
本题解析:(1)硫酸铵溶液中存在如下水解平衡:NH4++H2O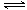 NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH4++H2O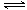 NH3?H2O+H+
NH3?H2O+H+
各组分起始浓度/mol?Lˉ1? 2.1? 0? 0
各组分变化浓度/mol?Lˉ1? 0.1? 0.1? 0.1
各组分平衡浓度/mol?Lˉ1? 2.0? 0.1? 0.1
K= =
= =5.00×10-3 mol?Lˉ1;
=5.00×10-3 mol?Lˉ1;
(4)先写硫酸铵水解反应:NH4++H2O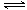 NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O
NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O  6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
本题难度:困难
4、选择题 一定温度下,下列叙述正确的是( )
A.向饱和AgCl水溶液中加入饱和NaCl溶液,c(Cl-)增大,AgCl的溶度积增大
B.将难溶电解质放入纯水中,溶解达平衡时,电解质离子的浓度的乘积就是该物质的溶度积
C.向含有AgCl固体的溶液中加入适量的水使AgCl溶解,重新达到平衡时,AgCl的溶度积不变,其溶解度也不变
D.AgCl的Ksp=1.8×10-10mol2?L-2,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10mol2?L-2
参考答案:A.向饱和AgCl水溶液中加入饱和NaCl溶液,c(Cl-)增大,溶度积只受温度的影响,溶度积不变,故A错误;
B.溶度积等于离子的浓度幂之积,离子带电荷不同,表达式不同,故B错误;
C.溶度积只受温度的影响,温度不变,溶度积不变,饱和溶液的浓度不变,溶解度不变,故C正确;
D.在含有Ag+或Cl-的溶液中,c(Ag+)、c(Cl-)不一定相等,但Ag+和Cl-浓度的乘积等于1.8×10-10,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 下列有关实验的叙述正确的是
[? ]
A.将SO2通入溴水溶液中溴水褪色,可以说明SO2有漂白性
B.将淀粉和稀硫酸混合后加热,再加入银氨溶液加热,可以检验淀粉水解后的产物
C.将C2H5OH与浓硫酸在170℃下共热,制得的气体直接通入酸性KMnO4溶液,可以检验生成的乙烯气体
D.向AgCl浊液中滴加KI溶液,白色沉淀转化为黄色沉淀,可以说明Agl比AgCl更难溶
参考答案:D
本题解析:
本题难度:一般