微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s)?△H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g)?△H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:?。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是?。
a.体系压强保持不变? b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变? d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=?。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为?(写出一种即可)。
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式?。
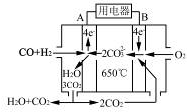
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。?
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为?。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是?。
参考答案:(14分)(每空2分)
(1)5CO(g) + I2O5(s)=5CO2(g) + I2(s)?△H=-1377.22kJ·mol-1
(2)b 2.67或8/3
(3)(NH4)3PO4或(NH4)2HPO4或NH4H2PO4
(4)O2 + 4e-+2CO2 = 2CO32-
(5)①1∶7?
②对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应
本题解析:能说明反应NO2+SO2 SO3+NO达到平衡状态:压强不变不作为判断依据,SO3和NO的体积比保持不变不可以作为判断的依据。每消耗1 mol SO2的同时消耗1 molNO是平衡状态的标志。平衡常数K=0.82/0.5×1.25=2.67.用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g
SO3+NO达到平衡状态:压强不变不作为判断依据,SO3和NO的体积比保持不变不可以作为判断的依据。每消耗1 mol SO2的同时消耗1 molNO是平衡状态的标志。平衡常数K=0.82/0.5×1.25=2.67.用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
X? X? X
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2?
Y? 0.5y
X+0.5Y=1? /28X+46(X+Y)---44(X+0.5Y)=44?X=1? Y=6
本题难度:一般
2、选择题 对化学反应限度的叙述中错误的是( )
A.任何可逆反应在给定条件下的进程都有一定的限度
B.化学反应达到限度时,反应物的浓度和生成物的浓度不再改变
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.化学反应的限度是不可改变的
参考答案:A.在一定条件下,当正逆反应速率相等时,可逆反应达到一定的限度,即平衡状态,故A正确;
B.在一定条件下,当达到化学反应限度时,正逆反应速率相等,反应物的浓度和生成物的浓度不再改变,故B正确;
C.当达到化学反应限度时,正逆反应速率相等,反应物的浓度和生成物的浓度不再改变,反应物在该条件下的转化率最大,故C正确;
D.当外界条件发生改变,平衡发生移动,化学反应限度变化,故D错误.
故选D.
本题解析:
本题难度:一般
3、选择题 可逆反应H2(g)+I2(g) 2HI(g)达到平衡时的标志是
2HI(g)达到平衡时的标志是
[? ]
A.H2、I2、HI的浓度相等
B.1个I-I键断裂的同时,有2个H-I键断裂
C.混合气体的质量不再改变
D.混合气体密度恒定不变
参考答案:B
本题解析:
本题难度:一般
4、填空题 (12分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO 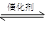 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
?
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
?
c(NO)/
mol·L-1
| 1.00×10-3
| 4.50×10-4
| 2.50×10-4
| 1.50×10-4
| 1.00×10-4
| 1.00×10-4
|
?
c(CO)/
mol·L-1
| 3.60×10-3
| 3.05×10-3
| 2.85×10-3
| 2.75×10-3
| 2.70×10-3
| 2.70×10-3
|
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K=?。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在上述条件下反应能够自发进行,则反应的 ?0(填写“>”、“<”、“=”)。
?0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是?。
A.选用更有效的催化剂? B.升高反应体系的温度
C.降低反应体系的温度? D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条
件数据。
实验编号
| T/℃
| NO初始浓度
mol·L-1
| CO初始浓度
mol·L-1
| 催化剂的比表面积
㎡·g-1
|
Ⅰ
| 280
| 1.2×10-3
| 5.8×10-3
| 82
|
Ⅱ
| ?
| ?
| 5.8×10-3
| 124
|
Ⅲ
| 350
| 1.2×10-3
| ?
| ?
|
?
参考答案:(12分)
(1)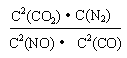 (2分)
(2分)
(2)1.88×10-4mol/(L·s) (2分)
(3)< (2分)
(4)C、D (2分)
(5)Ⅱ? 280 ? 1.2×10-3 (2分)
Ⅲ 5.80×10-3 124 ?(2分)
本题解析:(1)根据平衡常数的表达式可得;(2)根据前两秒的NO的浓度变化量求出生成氮气的浓度变化量,再除以时间可得用氮气表示的平均反应速率;(3)该反应气体系数和是减小的,△S<0,要使反应能够自发进行,则必须△H<0;(4)该反应为放热反应,降低温度平衡向右移动,NO的转化率提高,该反应为气体系数和减小的反应,故缩小体积增大压强平衡向右移动,NO的转化率增大,故选CD;(5)保证四个量中的其中三个相同,研究另外一个对反应速率的影响,I和Ⅱ研究的是催化剂的比表面积对反应速率的影响,故其它条件都相同;选择Ⅲ和Ⅱ研究温度对反应速率的影响,故只有温度不同,其它条件均相同。
本题难度:一般
5、填空题 在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
|
(1)写出该反应的平衡常数表达式:K=______,已知:K(300℃)>K(350℃),该反应是______反应(填“放热”或“吸热”).
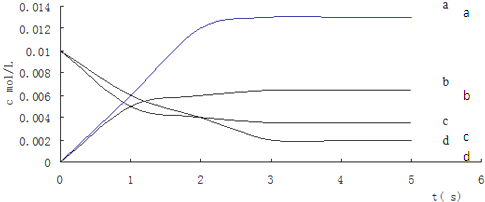
(2)图中表示NO2的变化的曲线是______,用O2的浓度变化表示从0~2s内该反应的平均速率v=______.
(3)能说明该反应已经达到平衡状态的是______
a.v(NO2)=2v(O2)?b.容器内压强保持不变
c.v逆(NO)=2v正(O2)?d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是______
a.及时分离出NO2气体? b.适当升高温度
c.增大O2的浓度? d.选择高效的催化剂.
参考答案:解(1)可逆反应2NO(g)+O2(g)?2NO2(g)的平衡常数k=c2(NO2)c2(NO)?c(O2),
K(300℃)>K(350℃),说明升高温度平衡向逆反应移动,故正反应是放热反应,
故答案为:c2(NO2)c2(NO)?c(O2),放热;
(2)由方程式2NO(g)+O2(g)?2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,由表中数据可知,平衡时c(NO)=0.007mol2L=0.0035mol/L,曲线b平衡时的浓度为0.0035mol/L,故曲线b表示NO2的浓度变化,
由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)=0.006mol/L2s=0.003mol/(L?s),根据速率之比等于化学计量数之比,故v(O2)=12v(NO)=12×0.003mol/(L?s)=0.0015mol/(L?s),
故答案为:b,0.0015mol/(L?s);
(3)a.始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,故a错误;
b.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,故b正确;
c.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),说明到达平衡,故c正确;
d.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故d错误;
故选bc;
(4)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;
b.适当升高温度,反应速率增大,平衡向逆反应移动,故b错误;
c.增大O2的浓度,反应速率增大,平衡向正反应移动,故c正确;
d.选择高效的催化剂,增大反应速率,不影响平衡移动,故d错误;
故选c.
本题解析:
本题难度:一般