|
高考化学知识点归纳《键参数——键能、键长与键角》高频试题强化练习(2017年最新版)(二)
2017-07-27 09:08:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
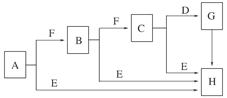
1、填空题 (8分)下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78。请回答相关问题:
(1)下列对C的结构、性质推断不正确的是( )
A.久置于空气中会变成白色
B.具有强氧化性
C.晶体中存在离子键与非极性键
D.是一种碱性氧化物
| (2)A的原子结构示意图为________,H的电子式为________,E的结构式为________。
(3)C和E反应生成H的离子方程式为________,反应中氧化剂与还原剂的物质的量之比为________。
参考答案:(1)A、D (2) Na+[········H]- Na+[········H]- 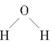
(3)2Na2O2+2H2O===4Na++4OH-+O2↑ 1 ∶1
本题解析:由A、B、C均可与E反应生成H而E在常温下是一种液体,猜测E为H2O,A是活泼金属Na,再由Na与O2生成Na2O,Na2O与O2生成Na2O2,Mr(Na2O2)=78而得到验证。
本题难度:一般
2、选择题 下面的叙述正确的是?
[? ]
A.两种非金属元素原子之间形成的化学键不一定都是极性键
B.共价化合物中可能含有离子键
C.只要是离子化合物其熔点就比共价化合物的熔点高
D.将某种化合物溶于水,若能导电说明这种化合物是离子化合物
参考答案:A
本题解析:
本题难度:简单
3、填空题 前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:

(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
参考答案:(1)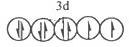
(2)K;F
(3)①K2NiF4;6;②3.4
(4)离子键和配位键;[FeF6]3-;F-
本题解析:前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素
(1)D2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为;
(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F;
(3)①该晶胞中A原子个数=16×1/4+4×1/2+2=8,B原子个数=8×1/4+2=4,D原子的个数=8×1/8+1=2,故该化合物的化学式为K2NiF4;由晶体的结构,D的配位数是6;
②该晶胞的体积=(400×10-10cm)2(1308×10-10cm)
(4)A-、B+和C3+三种离子组成的化合物的K3FeF6,该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-。
本题难度:一般
4、填空题 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为____________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
参考答案:(1)C<O<N 1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)sp2 平面三角形 (3)2NA或2×6.02×1023
(4)1∶5 (5)5 0.083 g·cm-3
本题解析:根据题中已知信息,第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级可知,A为碳元素,B为氮元素,C为氧元素,D为铜元素。晶胞的原子个数计算主要注意D原子个数计算,在晶胞上、下两个面上共有4个D原子,在前、后、左、右四个面上共有4个D原子,在晶胞的中心还有一个D原子。镧镍合金储氢后,1 mol晶体中氢元素的质量为4.5 g,则氢在合金中的密度为 =0.083 g·cm-3。 =0.083 g·cm-3。
本题难度:一般
5、选择题 下列化学用语正确的是( ? )
A.聚丙烯的结构简式为:

B.乙烯的结构简式:CH2CH2
C.CH4分子的比例模型:

D.四氯化碳分子的电子式为:
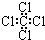
参考答案:C
本题解析:
本题难度:简单
|