微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
烯类化合物
| 相对速率
|
(CH3)2C=CHCH3
| 10.4
|
CH3CH=CH2
| 2.03
|
CH2=CH2
| 1.00
|
CH2=CHBr
| 0.04
|
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:___________________________________________________________________________。
(2)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_________________________,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有___________种。
(3)11.2 L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。A的分子式是_____________;
(4)丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A氢化后得到2?—甲基丙烷。A可以聚合,写出A的两种聚合方式(以反应方程式表示)。
参考答案:(1) ①C=C上甲基(烷基)取代,有利于加成反应
②甲基(烷基)越多,速率越大;
③C=C上溴(卤素)取代,不利于加成反应? (每点1分,共3分)
(2) C11H14O3 (2分)? 12? (2分)? (3)C4H10 ?(2分)
(4)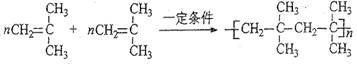 (2分)
(2分)
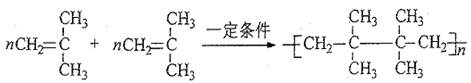 ?(2分)
?(2分)
本题解析:(1)则根据图表,第一个和第二个比乙烯的速率快,第一个和第二个是在乙烯的基础上取代上去烷烃基,且第一个比第二个速率还快,说明,烷烃基越多,速率越快;而第四个比乙烯慢,第四个是取代了溴原子,所以取代基为卤原子,不利于加快反应速率,即结论是①C=C上甲基(烷基)取代,有利于加成反应;②甲基(烷基)越多,速率越大;③C=C上溴(卤素)取代,不利于加成反应。
(2)尼泊金丁酯是对羟基苯甲酸与丁醇形成的酯类化合物,在反应中还生成1个水分子,所以根据原子守恒可知,化合物的分子式为C11H14O3 。苯环上的两个取代基,可以是邻、间、对三种。又因为丁醇有4种同分异构体,所以共计是3×4=12种。
(3)88 g CO2和45 g H2O分别是2mol和2.5mol,而有机物是0.5mol,所以共计原子守恒可知,A的分子式为C4H10。
(4)A氢化后得到2?—甲基丙烷,所以A的结构简式为CH2=C(CH3)2,由于分子中,2个不饱和碳原子是不同的,因此A有两种聚合方式,方程式为(见答案)
本题难度:一般
2、填空题 在下列事实中,什么因素影响了化学反应的速率??
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸______________;
(2)黄铁矿煅烧时要粉碎成细小的矿粒__________________;
(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2________________;
(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体__________________;
(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢__________________;
(6)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同_______________;
(7)夏天的食品易变霉,冬天就不易发生该现象__________________。
参考答案:(1)光
(2)反应物的接触面积
(3)在溶液中,水作溶剂,增大了接触面积
(4)催化剂
(5)反应物本身的性质
(6)反应物的浓度
(7)反应温度
本题解析:
本题难度:一般
3、选择题 下列反应中,改变温度、反应物的用量或浓度,不会改变生成物的是
A.硫化氢气体在氧气中燃烧
B.氯气通入氢氧化钠溶液中
C.细铁丝在硫蒸气中反应
D.硫酸与锌粒的作用
参考答案:C
本题解析:A:不完全燃烧产物为硫,完全燃烧产物为二氧化硫
B:低温时,生成次氯酸盐,否则生成氯酸盐
C:产物一定为硫化亚铁
D:稀硫酸时置换出氢气,浓硫酸时还原产物为二氧化硫
答案为C
本题难度:一般
4、选择题 ( 8分)将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应 3A+B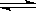 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
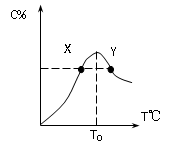
T0对应的反应速率V正和V逆的关系是_____(用含“>”“<”“=”表示,下同);
(2) 此反应的正反应为______热反应;
(3) X、Y两点A物质正反应速率的大小关系是______________;
(4) 温度T<T0时,C%逐渐增大的原因是________________________;
(5) 若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为_______;若Y点时所耗时间为2min,则B物质的反应速率为__________。
参考答案:(1)V正=V逆?(1分)?(2)放热反应;(1分)?(3)Y>X;(1分)
(4)反应未达到平衡,反应仍在向正反应方向进行,故C%的逐渐增大。(1分)
(5)1.8mol;(2分)0.06mol/L·min(2分)
本题解析:由图可知,曲线上的最高点为化学反应所能达到的最大限度即达到平衡状态。所以(1)T0对应的反应速率V正和V逆的关系是V正=V逆
(2)当可逆反应达到平衡后即T0时,再升高温度C%是减小的,说明该反应的正反应为放热反应;
(3)化学反应速率随温度的升高而增大,固X、Y两点A物质正反应速率的大小关系是Y>X
(4)温度T<T0时,C%逐渐增大的原因是,此时反应未达到平衡状态,此时V正>V逆,反应向正反应方向进行。
(5)设在反应过程中B的物质的量变化为x;
根据化学反应方程式3A?+? B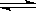 2C
2C
起始物质的量? 3mol? 3mol? 0
变化物质的量? 3x? x? 2x
反应后物质的量? 3-3x? 3-x? 2x
即可得: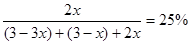 ;
;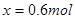
所以求得正确答案。
本题难度:简单
5、选择题 一定量的盐酸和过量的铁粉反应时,为了增大反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
A.NaOH(s)
B.NaCl(s)
C.CuSO4 (s)
D.H2O
参考答案:C
本题解析:略
本题难度:一般