微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用惰性电极电解一定量的Cu(NO3)2溶液,下列说法中,正确的是? (? )
A.阳极发生的电极反应为:Cu2++2e-=Cu
B.阴极发生的电极反应为:4OH-=2H2O+O2↑+4e―
C.若有6.4 g金属Cu析出,放出的O2一定为0.05 mol
D.电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度
参考答案:D
本题解析:
正确答案:D
A.不正确,阴极发生的电极反应为:Cu2++2e-=Cu?
B.不正确,阳极发生的电极反应为: 2H2O―4e―=O2↑+4H+
C.不正确,只有在Cu(NO3)2足量的情况下,若有6.4 g金属Cu析出,放出的O2一定为0.05 mol
D、正确,当Cu (NO3)2电解结束后,电解水。
本题难度:一般
2、选择题 用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子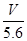 NA
NA
B.n = 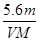
C.溶液中H+增加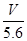 NA
NA
D.n = 
参考答案:B
本题解析:阳极:4OH--4e-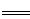 2H2O+O2↑
2H2O+O2↑
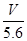 ?mol?
?mol?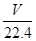 mol
mol
阴极:Rn+?+?ne-? ?R
?R
n mol?M
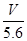 ?mol?m g?n =
?mol?m g?n =  ?
?
电解时,电池反应方程式为:
4R(NO3)n+2nH2O 4R+nO2↑+4nHNO3
4R+nO2↑+4nHNO3
e- ?~? H+
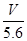 ?mol?
?mol?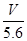 ?mol
?mol
所以B不正确。
本题难度:一般
3、选择题 蝇类昆虫的雌性信息素可用芥酸(来自白芥)与羧酸X在浓NaOH溶液中进行阳极氧化得到。电解总反应式为
C21H41COOH芥酸+X+4NaOH―→C23H46(雌性信息素)+2Na2CO3+2H2O+H2↑
则下列说法正确的是? ( )
A.X为C3H7COOH
B.电解的阳极反应式为C21H41COOH+X-2e-+2H2O=C23H46+CO32—+6H+
C.电解过程中阴极区pH增大,Na+向阴极移动
D.阴极的还原产物为H2和OH-
参考答案:C
本题解析:依据原子守恒可知X化学式为C3H6O2,A错误;B选项中有CO32—生成一定无H+生成,错误;H+在阴极得电子可知生成H2,所以电解过程中阴极区pH增大,C选项正确;OH-不是还原产物,D选项错误。
本题难度:一般
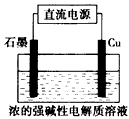
4、选择题 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:
2Cu+H2O Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
[? ]
A.铜电极发生还原反应
B.石墨电极上产生氢气
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
参考答案:B
本题解析:
本题难度:一般
5、简答题 “化学与技术”模块
海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.
(1)常用的海水淡化方法有______法、______法(电渗析、反渗透)、冷冻法、离子交换法等.
(2)如图是电渗析法淡化海水的原理图.其中,电极A接直流电源的正极,电极B接直流电源的负极.
①隔膜A是______(填:阴离子交换膜或阳离子交换膜)
②从宁波港采集的海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-.
若用上述装置对采自宁波港的海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、
pHc,则其大小顺序为______.
③请写出用电渗析法对采自宁波港的海水进行淡化处理时所发生的化学反应方程式______.
(3)具有暂时硬度的硬水在长时间加热煮沸后,生成沉淀的主要成分是______.
(4)为获得纯净水(去离子水),某同学在实验室将含Mg2+、Ca2+、Cl-的硬水先后通过阴离子交换树脂[如RN(CH3)3OH]和阳离子交换树脂[如RSO3H],写出Cl-与上述离子交换反应的方程式______;结果实验未获得成功,其可能原因是______.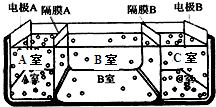
参考答案:(1)海水淡化常见的方法有:蒸馏法、膜法、冷冻法、离子交换法等,故答案为:蒸馏;膜;
(2)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜A和阳极相连,阳极是阴离子放电,所以隔膜A是阴离子交换膜,故答案为:阴离子交换膜;
②电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc,故答案为:pHa<pHb<pHc;
③电解氯化钠的反应原理为:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑;
(3)水垢的主要成分是氢氧化镁和碳酸钙,也是具有暂时硬度的硬水在长时间加热煮沸后生成沉淀的主要成分,故答案为:CaCO3、Mg(OH)2;
(4)阴离子交换树脂可以实现阴离子之间的交换,所以Cl-与阴离子交换树脂反应的方程式为:RN(CH3)3OH+Cl-═RN(CH3)3Cl+OH-,碱性环境下,镁离子易形成沉淀物,会堵塞了离子交换柱,所以离子交换树脂有时不起作用,故答案为:阴离子交换树脂交换出的OH-和Mg2+、Ca2+等反应生成沉淀堵塞了离子交换柱.
本题解析:
本题难度:一般