微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL。
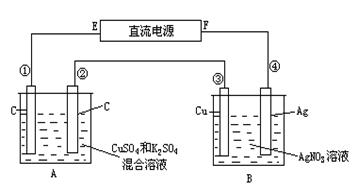
试求:(1)写出①、②的电极反应式; ______________ _______________
(2)通过计算确定通电前A池中原混合溶液Cu2+的浓度是 。
参考答案:(1)①Cu2++2e-==Cu (2分) 2H++2e-==H2↑(2分)
②4OH—4e-=2H2O+O2↑(2分)
(2)0.025mol/L (2分)
本题解析:(1)B池第③极增重2.16 g,电解硝酸银溶液得到的产物是Ag和氧气,所以2.16g是Ag的质量,电路中转移电子的物质的量是2.16g/108g/mol=0.02mol,所以③极是阴极,则④是阳极,F是电源的正极,E是电源的负极,①是阴极,②是阳极,所以①发生还原反应,根据离子的放电顺序,铜离子得电子生成单质Cu,电解反应式为Cu2++2e-==Cu,②发生氧化反应,氢氧根离子放电生成氧气,4OH—4e-=2H2O+O2↑,根据得失电子守恒可知,生成氧气的物质的量是0.02mol/4=0.005mol,标准状况下的体积是0.005mol×22.4L/mol=0.112L=112mL,而实际A池中收集到标准状况下的气体224 mL,说明阴极除铜离子放电外还有氢离子 放电,且生成112mL的氢气,电解反应式为2H++2e-==H2↑;
(2)由(1)的分析可知,A池中生成的氢气的物质的量是0.112L/22.4L/mol=0.005mol,转移电子的物质的量是0.005mol×2=0.01mol,阴极共转移电子的物质的量是0.02mol,所以Cu2+得电子的物质的量是0.01mol,则Cu2+的物质的量是0.01/2=0.005mol,A池溶液的体积是200mL,所以通电前A池中原混合溶液Cu2+的浓度是0.005mol/0.2L=0.025mol/L.
考点:考查电化学反应原理的应用,氧化还原反应的计算
本题难度:一般
2、选择题 用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,且已知Fe2(SO4)3+Cu=2FeSO4+CuSO4,下列说法正确的是( )
A.阴极反应式为:Cu2++2e-═Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.阴极先是Fe3+放电,后Cu2+放电
D.阴极上不可能析出铜
参考答案:A.由反应Fe2(SO4)3+Cu=2FeSO4+CuSO4可知,氧化性:Fe3+>Cu2+,则Fe3+得电子能力比Cu2+强,所以,在阴极首先得电子的是Fe3+,当Fe3+存在时,Cu2+不放电,故A错误;
B.当Fe3+完全反应后Cu2+放电,首先析出铜,故B错误;
C.因氧化性:Fe3+>Cu2+,阴极先是Fe3+放电,后Cu2+放电,故C正确;
D.由B分析可知,当Fe3+完全反应后Cu2+放电,可析出铜,故D错误.
故选C.
本题解析:
本题难度:一般
3、填空题 (10分)电解饱和食盐水可产生氯气、氢气和氢氧化钠,氯气与石灰乳反应可制得漂白粉。
(1)请写出上述过程中发生反应的化学方程式。
(2)若电解饱和食盐水时消耗NaCl? 117g, 试计算理论上最多可得到氯气的体积(标准状况)。
(3)若将2 mol氯气通入足量石灰乳中,理论上可得到次氯酸钙多少克?
参考答案:(1)略? 4分
(2)22、4L? 3分
(3)143g? 3分
本题解析:略
本题难度:一般
4、选择题 在25℃时,用铂电极电解一定量的Na2SO4饱和溶液,一段时间后,阳极析出amol气体,同时溶液中析出bg Na2SO4·10H2O,如果在这一过程中温度不变,则此时Na2SO4溶液中溶质的质量分数为(?)
A.(71/161)×100℅
B.〔71b/161(18a+b)〕×100℅
C.〔b/(18a+b)〕×100℅
D.〔71b/161(36a+b)〕×100℅
参考答案:B
本题解析:略
本题难度:简单
5、简答题 海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
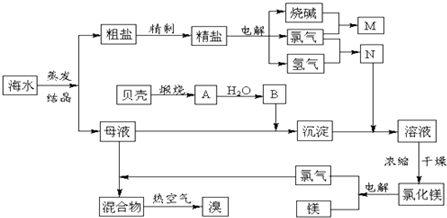
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸?B.氯化钡溶液?C.氢氧化钠溶液?D.碳酸钠溶液.
则加入试剂的顺序是(填编号)______.
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是______.
A.精制饱和食盐水进入阳极室?B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气?D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式:______.
(4)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)______.
(5)利用MgCl2?6H2O可制得无水氯化镁,应采取的措施是______.
(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:______.
参考答案:(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为BDCA 或 CBDA 或BCDA等
故答案为:BDCA 或 CBDA 或BCDA等;
(2)A、阳极是氯离子失电子发生氧化反应,精制饱和食盐水进入阳极室,故A正确;
B、阴极是氢离子得到电子生成氢气,纯水(加少量NaOH)进入阴极室,故B正确;
C、阴极是氢离子得到电子生成氢气发生还原反应,阴极附近水电离平衡破坏,氢氧根离子浓度增大结合钠离子生成氢氧化钠,故C正确;
D、.电解槽的阳极是石墨电极,溶液中的氯离子失电子生成氯气,若用用金属铁网制成,则铁是电子发生氧化反应,生成的亚铁离子和氢氧根离子形成沉淀,得不到氯气和烧碱,故D错误;
故选D.
(3)电解过程中阳极上氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极上是氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;电解池中反应的离子方程式为:2Cl-+2H2O?通电?.?Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O?通电?.?Cl2↑+H2↑+2OH-;
(4)石灰石可以用作制玻璃的原料,发生的反应为:CaCO3+SiO2?高温?.?CaSiO3+CO2↑,故答案为:2Cl-+2H2O?通电?.?Cl2↑+H2↑+2OH-;
(5)氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,故答案为:在HCl气流中加热脱水(防止MgCl2水解);
(6)溴单质具有氧化性,亚硫酸钠具有还原性发生氧化还原反应生成硫酸钠和氢溴酸;反应的化学方程式为:H2O+Na2SO3+Br2═Na2SO4+2HBr,故答案为:H2O+Na2SO3+Br2═Na2SO4+2HBr.
本题解析:
本题难度:一般