微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)运用甲烷自热来制取氢气是目前较为先进的技术。其涉及的反应如下:
①CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1=+165.0 kJ/mol 反应活化能Ea1="243.9" kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-802.6 kJ/mol 反应活化能Ea2="125.6" kJ/mol
(1)2H2(g) + O2(g)= 2H2O(g)△H3= kJ/mol;
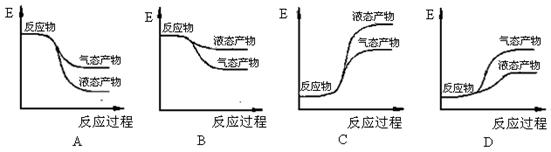
(2)下面能正确表示氢气和氧气反应生成水的能量变化示意图的是 (填字母序号)。
(3)运用甲烷自热来制取氢气是目前较为先进的技术。在同一反应系统同时通入甲烷、氧气和水蒸气,发生如上反应①和反应②,则反应开始时,反应①的反应速率 反应②的反应速率(填“>”、“<”或“=”),理由是 ;从能量角度分析,在该制氢过程中通入适量氧气发生反应②的目的是 ;
参考答案:(1)-483.8 (2分); (2)A (2分)
(3)<(2分);反应①的活化能比反应②的活化能高;(2分)
甲烷与氧气反应放热,为反应①提供所需能量(2分)
本题解析:(1)由盖斯定律可知:2H2(g) + O2(g)= 2H2O(g)△H3=-1/2△H1+1/2△H2="-483.8" kJ/mol;(2)氢气和氧气反应生成水为放热反应,故反应物总能量大于生成物总能量,且气态水变液态水为放热过程,故A项正确;由题干可知反应①的活化能比反应②的活化能高,故反应①的反应速率<反应②的反应速率;反应①为吸热,反应②为放热,故从能量角度分析,在该制氢过程中通入适量氧气发生反应②的目的是甲烷与氧气反应放热,为反应①提供所需能量。
考点:化学反应能量变化。
本题难度:困难
2、填空题 已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g) CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
温度/℃
| 500
| 700
| 900
|
K
| 1.00
| 1.47
| 2.40
|
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。(2)反应①为 (选填“吸热”或“放热”)反应。(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。A.缩小反应器体积 B.通入CO2
C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
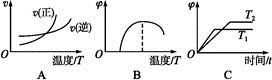
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
参考答案:(1)1 mol·L-1 (2)吸热 (3)BC (4)A
(5)2(a+b) kJ·mol-1(6)2Fe(s)+3/2O2(g) Fe2O3(s)ΔH="(3b-c)" kJ·mol-1
Fe2O3(s)ΔH="(3b-c)" kJ·mol-1
本题解析:(1)(2)依据反应①,可写出该反应的化学平衡常数表达式K=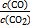 ,从表中数据观察到:K值随温度升高而增大,说明正反应为吸热反应。在500 ℃时,假设CO2转化了x mol·L-1,达到平衡状态时,有下式成立:K=
,从表中数据观察到:K值随温度升高而增大,说明正反应为吸热反应。在500 ℃时,假设CO2转化了x mol·L-1,达到平衡状态时,有下式成立:K=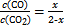 =1.00,解得x=1,即平衡时CO的浓度为1 mol·L-1。
=1.00,解得x=1,即平衡时CO的浓度为1 mol·L-1。
(3)中,700 ℃时反应①达到平衡,要使该平衡向右移动,可以升高体系温度、增大反应物浓度(通入CO2),注意不要错选选项E,因为反应物Fe是固体,改变固体或纯液体的量对平衡无影响。
(4)中,图像A是温度改变对反应速率的影响,由于反应①的正反应是吸热反应,所以升高温度,正逆反应速率均增大,但正反应速率增大的幅度大,故A正确。图像B是温度改变对混合物中CO含量的影响,温度较低时反应不进行,随着温度升高混合物中CO的含量逐渐增大,不会减小,故B错误。图像C中T1>T2,温度升高平衡向右移动,则CO的含量高,故C错误。
(5)中,由反应①和②,进行如下处理:①+②,得到:
Fe(s)+O2(g) FeO(s) ΔH="(a+b)" kJ·mol-1,
FeO(s) ΔH="(a+b)" kJ·mol-1,
故反应2Fe(s)+O2(g) 2FeO(s)的ΔH="2(a+b)" kJ·mol-1。
2FeO(s)的ΔH="2(a+b)" kJ·mol-1。
(6)中,由反应③和②,进行如下处理:③-②×3,得到:
Fe2O3(s) 2Fe(s)+O2(g) ΔH="(c-3b)" kJ·mol-1,
2Fe(s)+O2(g) ΔH="(c-3b)" kJ·mol-1,
所以Fe固体被O2氧化得到Fe2O3固体的热化学方程式为:
2Fe(s)+O2(g) Fe2O3(s) ΔH="(3b-c)" kJ·mol-1。
Fe2O3(s) ΔH="(3b-c)" kJ·mol-1。
本题难度:困难
3、填空题 日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
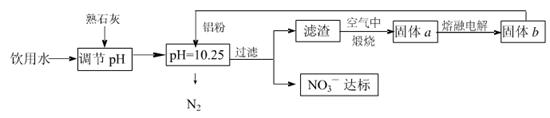
请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成 的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为 。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 。
(4)饮用水中的NO3- 主要来自于NH4+。已知在微生物作用下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:
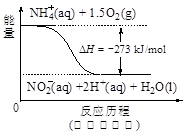
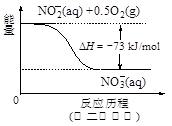
试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
(5)固体a熔融电解时阴极反应式为
参考答案:(1)铝(或Al)(2分)
(2)①10Al+6NO3—+18H2O=10Al(OH)3↓+3N2↑+6OH—(2分)
②4Al+ 3O2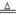 2 Al2 O3 2Al(OH)3
2 Al2 O3 2Al(OH)3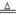 Al2 O3+3 H2O(各2分)
Al2 O3+3 H2O(各2分)
(3)5H2+2NO3— N2↑+4H2O+2OH— (2分)
N2↑+4H2O+2OH— (2分)
(或5H2+2NO3—+2H+ N2↑+6H2O)
N2↑+6H2O)
(4)NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l) △H=-346 kJ·mol-1(2分)
(5)Al3++3e-= Al(2分)
本题解析:(1)由于铝能和酸或碱都能反应,该方案在调节pH时,若pH过大或过小都会造成铝(或Al) 的利用率降低。(2)①铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3
本题难度:困难
4、选择题 下列有关热化学方程式的表示及说法正确的是( )
A.已知c(石墨,s)=c(金刚石,s)△H>0,则金刚石比石墨稳定
B.已知H2(g)+F2(g)═2HF(g)△H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
C.HCl和NaOH反应的中和热为-57.3kJ/mol,则H2SO4和Ba(oH)2反应的中和热△H=2×(-57.3)kJ/mol
D.已知I2(g)+H2(g)═2HI(g)△H1;I2(s)+H2(g)═2HI(g)△H2;则△H1<△H2
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)==="2CO(g)" ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A.ΔH1>0, ΔH3<0
B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3
D.ΔH3=ΔH4+ΔH5