微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F
B.M是极性分子,其还原性比NH3强
C.M既是氧化产物,又是还原产物
D.4moNH3参加反应失去12mol电子
参考答案:BD
本题解析:A.正确;B.M:NF3是极性分子,其还原性不比NH3强,错误;C.M:NF3既是氧化产物,又是还原产物,正确;D.4moNH3参加反应失去6mol电子,错误。
本题难度:一般
2、选择题 水在下列化学反应中,作还原剂的是( ?)
A.2F2+2H2O=4HF+O2
B.Cl2+H2O=HCl+HClO
C.Na2O+H2O=2NaOH
D.2Na+2H2O=2NaOH+H2↑
参考答案:A
本题解析:还原剂在化学反应中失去电子化合价升高,据此可以判断H2O在化学反应中的作用。
本题难度:简单
3、选择题 为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞的含量。发生的化学反应为:4CuI+Hg = Cu2HgI4+2Cu 。下列说法不正确的是
A.上述反应属于置换反应
B.该反应中的氧化剂与还原剂的物质的量之比为2:1
C.Cu2HgI4既是氧化产物又是还原产物
D.当有1 mol CuI参与反应时,转移电子的物质的量为0.5 mol
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (8分)氮氧化物(如NO2、NO等)进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾.因此必须对含有氮氧化物的废气进行处理.
(1)用氢氧化钠溶液可吸收废气中的氮氧化物.反应的化学方程式如下:
NO2 +NO+2NaOH═2NaNO2+H2O?①2NO2 + 2NaOH═NaNO2+ NaNO3?+ H2O?②
在反应①中,产物NaNO2中N元素的化合价为?,氧化剂与还原剂的质量之比为?;在反应②中,氧化剂是?,还原剂是?。
(2)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使他们发生反应生成无毒气体,该反应的化学方程式为?。
(3)亚硝酸钠
氨气(NH3)也可用来处理氮氧化物.例如,氨气与二氧化氮反应:8NH3+6NO2═7N2+12H2O.
若某工厂排出废气中NO2含量为0.5%(体积分数),则处理1.0×103米3(标准状况)这种废气,需要 ?千克氨气 (计算结果保留2位小数)。
参考答案:(8分)(1)+3 ,23:15 ,二氧化氮 ,二氧化氮?(每空1分)
(2)2 NO +2 CO 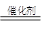 2 CO2 ?+ N2(2分)?(3)5.06?(2分)
2 CO2 ?+ N2(2分)?(3)5.06?(2分)
本题解析:(1)根据化学式可知,产物NaNO2中N元素的化合价为+3价。其中NO2中氮元素的化合价从+4价降低到+3价。NO中氮元素的化合价显从+2价升高到+3价,因此氧化剂和还原剂的物质的量之比是1:1。在反应②中只有氮元素的化合价发生变化,所以NO2既是氧化剂也是还原剂。
(2)说明生成物应该是氮气和CO2,反应的化学方程式是CO和NO发生反应生成无毒气体,2 NO +2 CO 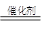 2 CO2 ?+ N2。
2 CO2 ?+ N2。
(3)1.0×103米3(标准状况)这种废气中NO2的体积是1.0×103米3×0.5%=5m3=5000L,所以根据反应的化学方程式可知,需要氨气的体积是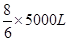 ,则标准状况下氨气的质量是
,则标准状况下氨气的质量是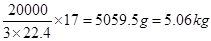 。
。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和训练。有利于培养学生的逻辑推理能力,提高学生分析问题、解决问题的能力。也有利于培养学生的环境保护意识,增强学生的学习积极性。
本题难度:一般
5、填空题 (1)某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗敖在铁架台的铁圈中:
B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞:
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞: