微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离子,同时析出0.1 mol Ag。下列结论错误的是(?)
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+物质的量比为1∶2
D.1 mol Fe可还原2 mol Fe3+
参考答案:A
本题解析:0.1 mol Fe全部溶解且无Fe3+,所以变化中共失去0.2 mol e-,又有0.1 mol Ag生成,其共得到0.1 mol e-,据得失电子守恒,则Fe3+→Fe2+,而发生了Fe+2Fe3+====3Fe2+,所以氧化性是Ag+>Fe3+>Cu2+>Zn2+,所以A错。B、C、D正确。
本题难度:简单
2、填空题 (1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反应中物质的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为_____________。
(2)配平下列氧化还原反应方程式:___KMnO4+___H2S+__H2SO4(稀) —— __K2SO4+__MnSO4+__S↓+__H2O
(3)Cl2是一种黄绿色有毒气体,化工厂可用浓氨水来检验有毒气体Cl2是否泄漏,有关反应的化学方程式为:3Cl2+8NH3=6NH4Cl +N2若反应中NH3消耗6.8 g,则转移电子个数为?。
参考答案:(1)
 ? >? 5:2
? >? 5:2
(2)2 KMnO4+5H2S+3H2SO4(稀) ==?1K2SO4+2MnSO4+5S↓+8H2O
(3)0.3 NA或1.806×1023个
本题解析:(1)HCl失去10电子给KMO4,且KMnO4作氧化剂,氧化性大于HCl。氧化产物是Cl?2,还原产物是MnCl2。(2)利用电子得失相等和原子个数守恒,可以配平。(3)反应了6.8g的NH3,,实际发生氧化反应的0.1mol NH3,应转移0.3 NA个电子。
本题难度:一般
3、选择题 下列叙述正确的是
A.非金属元素形成的离子一定是阴离子
B.非金属单质在氧化还原反应中一定是氧化剂
C.某元素从化合态变为游离态时,一定被还原
D.金属阳离子被还原不一定得到金属单质
参考答案:D
本题解析:A.非金属元素形成的离子可以是阳离子如NH4+,也可以是阴离子如CO32-等。错误。B.如在反应Cl2+H2O HCl+HClO中Cl2既是氧化剂又是还原剂。错误。C.某元素从化合态变为游离态时,可能是被还原如在H2+CuO
HCl+HClO中Cl2既是氧化剂又是还原剂。错误。C.某元素从化合态变为游离态时,可能是被还原如在H2+CuO Cu+H2O的Cu元素,也可能是被氧化,如在Cl2+2KI=2KCl+I2的I元素。错误。D.金属阳离子被还原可能得到金属单质H2+CuO
Cu+H2O的Cu元素,也可能是被氧化,如在Cl2+2KI=2KCl+I2的I元素。错误。D.金属阳离子被还原可能得到金属单质H2+CuO Cu+H2O,也可能得到金属化合物。如2FeCl3+Zn=2FeCl2+ZnCl2.正确。
Cu+H2O,也可能得到金属化合物。如2FeCl3+Zn=2FeCl2+ZnCl2.正确。
本题难度:简单
4、选择题 在反应3Cl2+6KOH 5KCl+KClO3+3H2O中,得电子的原子和失电子的原子个数比是(? )
5KCl+KClO3+3H2O中,得电子的原子和失电子的原子个数比是(? )
A.5∶1
B.1∶5
C.1∶1
D.3∶1
参考答案:A
本题解析:分析题中反应知氧化剂和还原剂都是Cl2,采用分散逆推法分析,氧化剂 还原产物,
还原产物, ;还原剂
;还原剂 氧化产物,
氧化产物,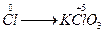 。在反应物所含的6个
。在反应物所含的6个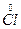 中,5个
中,5个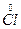 得到电子变为5个
得到电子变为5个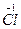 ,1个
,1个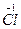 失去电子变为1个
失去电子变为1个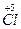 ,所以得电子的氯原子与失电子的氯原子个数比5∶1。
,所以得电子的氯原子与失电子的氯原子个数比5∶1。
本题难度:简单
5、选择题 在以下4个反应中,铁元素的化合价变化与另外3个反应不同的是
A.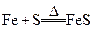
B.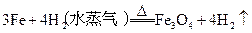
C.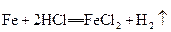
D.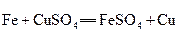
参考答案:B
本题解析:略
本题难度:简单