微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于某一反应中的反应物和生成物.下列叙述不正确的是( )
A.该反应一定为氧化还原反应
B.若NH4+为产物,则Fe3+也是产物
C.该反应过程中,溶液的pH不断增大
D.该反应的离子方程式中,Fe2+、NH4+两者计量数之比为1:8
参考答案:发生反应的离子方程式为8Fe2++NO3-+10H+=8Fe3++NH4++H2O,则
A.反应中有元素化合价的变化,所以一定是氧化还原反应,故A正确;
B.依据电子守恒和原子守恒电荷守恒,写出的氧化还原反应的离子方程式判断,若NH4+为产物,则Fe3+也是产物,故B正确;
C.反应过程中消耗氢离子溶液PH增大,故C正确;
D.该反应的离子方程式中,Fe2+、NH4+两者计量数之比为8:1,故D正错误;
故选D.
本题解析:
本题难度:一般
2、简答题 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下:
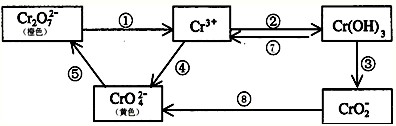
回答下列问题:
(1)上述转化关系中属于氧化还原反应的是______(填编号),其中需要使用氧化剂的是______(填编号).
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______.
(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:______.
(4)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式.阳极______ 阴极______溶液中______.
(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是______.
参考答案:(1)上述几步转化中,①中Cr元素的化合价降低,④⑧中Cr元素的化合价升高,则①④⑧属于氧化还原反应,且④⑧中需要加入氧化剂,
故答案为:①④⑧;④⑧;
(2)由Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色及转化⑤可知,发生的离子反应为2CrO42-+2H+

?Cr2O72-+H2O,
故答案为:2CrO42-+2H+

?Cr2O72-+H2O;?
(3)转化图中只有氢氧化铬与氢氧化铝类似,则氢氧化铬具有两性,能与碱反应,离子反应为Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;?
(4)铁作阳极,则阳极反应为Fe-2e=Fe2+,溶液中的阳离子H+在阴极放电,则阴极反应为H++2e=H2↑,电解产生的亚铁离子具有还原性,与
Cr2O72-发生氧化还原反应,Cr2O72-转化为Cr3+,则溶液中发生的离子反应为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:Fe-2e=Fe2+;H++2e=H2↑;6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O; ?
(5)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,
设Na2CrO4和NaCl的浓度都为1mol/L,
Ag2CrO4沉淀时需要的c(Ag+)=
本题解析:
本题难度:一般
3、填空题 A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(1)A的化学式为______,B的化学式为______,C的电子式为______.
(2)Z和W在催化剂和加热的条件下反应生成C和Y,这是一个很有意义的反应,可以消除W对环境的污染,该反应的化学方程式为______.
(3)将N溶液滴入G的溶液中会产生W,写出上述变化的离子反应方程式:______.
(4)Z与N恰好反应后产物溶解在水中,所得溶液的pH(填“大于”、“小于”或“等于”)______7,用离子反应方程式表示其原因为______.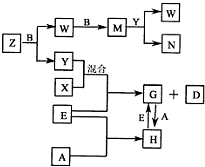
参考答案:A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属,则E为铁;Y、Z与Ne的电子数相等,则Y、Z为10电子微粒,再由框图中G与H的转化可知,A是第三周期的元素,A在常温下为气体,则A为氯气,H为氯化铁,G为氯化亚铁;再由转化中X与Y混合与铁反应,则D为氢气,X为氯化氢,Y为水,即B为氧气;由Z和B→W,W和B→M,M和Y反应生成W和N,则Z为氨气,即C为氮气,W为NO,M为NO2,N为硝酸;
(1)因A为氯气,其化学式为Cl2,B为氧气,其化学式为O2,C为氮气,其电子式为
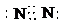
,故答案为:Cl2;O2;
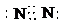
;
(2)Z和W在催化剂和加热的条件下反应生成C和Y,即氨气和NO反应生成氮气和水,其反应为6NO+4NH3

5N2+6H2O,
故答案为:6NO+4NH3

5N2+6H2O;
(3)将N溶液滴入G的溶液中会产生W,即硝酸滴到氯化亚铁溶液中发生氧化还原反应生成NO,离子反应为4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+,
故答案为:4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+;
(4)Z与N恰好反应后产物溶解在水中所得溶液为硝酸铵溶液,由铵根离子的水解反应NH4++H2O

NH3?H2O+H+可知该溶液显酸性,溶液的pH小于7,
故答案为:小于;NH4++H2O

NH3?H2O+H+.
本题解析:
本题难度:一般
4、选择题 下列反应属于氧化还原反应的是( )
A.H2+Cl2
2HCl
B.CaCO3+2HCl=CaCl2+CO2↑+H2O
C.CuSO4+BaCl2=BaSO4↓+CuCl2
D.NH4HCO3NH3↑+CO2↑+H2O
参考答案:A项中的反应中有化合价变化,氢元素化合价升高从0~+1;氯元素化合价降低从0~-1;故A是氧化还原反应;
B、C、D选项的反应,标注化合价,反应前后化合价没有变化,故B、C、D都不是氧化还原反应.
故选A.
本题解析:
本题难度:一般
5、简答题 将一铝片投入500mL?3mol/L的H2SO4溶液中.
(1)写出所发生反应的化学方程式并用双线桥分析电子转移的方向和数目.
(2)当生成11.2L(标准状况下)H2时,求此时溶液中H+的物质的量浓度.(假设溶液体积仍为500mL)
参考答案:(1)反应中Al的化学键由0价升高为+3价,H元素的化合价由+1价降低到0价,氧化剂为H2SO4,还原剂为Al,
用双线桥法可表示如下:
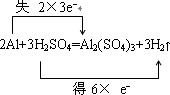
答:

;
(2)n(H2SO4)=0.5L×3mol/L=1.5mol,n(H2)=11.2L22.4L/mol=0.5mol,
2Al+3H2SO4=Al2(SO4)3+3H2↑
? 0.5mol?0.5mol
所以剩余硫酸的物质的量为1.5mol-0.5mol=1mol,
则:反应后溶液中n(H+)=2mol
c(H+)=2mol0.5L=4mol/L,
答:溶液中H+的物质的量浓度为4mol/L.
本题解析:
本题难度:一般