微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质按酸、碱、盐分类顺序排列的是
A.硫酸、纯碱、干冰
B.氢氯酸、烧碱、硫酸钡
C.碳酸、酒精、醋酸钠
D.磷酸、铜绿、氯化铁
参考答案:B
本题解析:氢氯酸即盐酸,属于酸;烧碱是氢氧化钠,属于碱;硫酸钡属于盐.
本题难度:困难
2、选择题 下列物质中阳离子半径与阴离子半径比值最小的是(?)
A.NaCl
B.LiF
C.LiCl
D.KF
参考答案:C
本题解析:阳离子半径与阴离子半径比值最小的应该是阳离子半径较小的和阴离子半径较大的离子构成的化合物,同一周期的离子电荷数大的半径小,同一族的原子序数大的半径大,在选项的三个阳离子中,Li+是阳离子半径最小的,在阴离子中,Cl-是阴离子半径最大的,所以C的比值最小。
故选C。
点评:本题考查学生离子半径大小比较的方法,要善于根据题意挖掘出暗藏的条件,难度较大。
本题难度:简单
3、选择题 下列说法正确的是
A.酸只有一种分类方法,可分为含氧酸和无氧酸
B.碱只有两种分类方法,可分为强碱和弱碱,也可分为一元碱、二元碱等
C.氧化物不可进一步分类
D.树状分类法和交叉分类法都是常用分类方法
参考答案:D
本题解析:分类的标准和方法不同,得到的结论也不相同,对物质和化学反应也是这样,每一类物质一般都有许多分类方法,A、B、C选项都是错误的,D选项正确.
本题难度:简单
4、填空题 有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码
| X
| Y
| Z
| W
|
原子核数
| 单核
| 不同元素构成的两核
| 同元素构成的两核
| 同元素构成的两核
|
粒子的电荷数
| 0
| 0
| 两个负电荷
| 0
|
?
(1)A原子核外比X原子多3个电子,A的原子结构示意图是?。含lmolX的氧化物晶体中含有共价键数目为?。
(2)Z与钙离子组成的化合物的电子式为?。
(3)14gY完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式?。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(丁为金属单质,反应条件和其他物质已略)

①写出丁元素在周期表中的位置?。
②写出丁在高温下与水反应的化学方程式?。
③组成W的元素的简单氢化物极易溶于水的主要原因是?,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为?。
参考答案:(1)氯原子结构示意图(略)? 4NA或2.408×1024 ?
(2)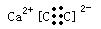
(3)2CO(g)+O2=2CO2(g);ΔH=-566KJ/mol?其他合理答案也可得分
(4)①第四周期第Ⅷ族?②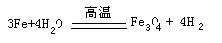
③NH3与H2O都是极性分子,极性相似(或NH3与H2O间能形成氢键), 2NH3-6e+6OH-═N2+6H2O
本题解析:根据题意可知这四种物质分别是:X为Si,Y为CO,Z为C22_,Z为N2.(1)X为14号元素Si,则A 为17元素氯。其原子结构示意图略。二氧化硅为原子晶体,每个Si原子与4个O原子通过共价键结合,故含lmolSi的氧化物晶体中含有共价键数目为4NA或2.408×1024.
(2)由于Z为C22_,Z与钙离子组成的化合物的电子式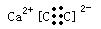
(3)Y为CO,其摩尔质量为28g/mol.n(CO)="0.5" mol其热化学方程式为:2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol.其他合理答案也可得分。
(4)①由题意知甲为HNO3,能与硝酸反应,且加入的量多少不同,产物不同的金属只有Fe,其在元素周期表中位于第四周期第Ⅷ族,②在高温下铁与水反应的化学方程式是: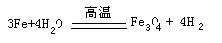
③NH3、H2O都是极性分子,NH3、H2O之间除了分子间的作用力外,还存在存在氢键,增加了相互作用。根据相似相溶原理,氨气易溶解于水。氨气与空气组成的燃料电池,氨气为负极,空气为正极。其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O。
本题难度:一般
5、填空题 A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素
| 有关性质或结构信息
|
A
| 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9%
|
B
| B原子得到一个电子后3p轨道全充满
|
C
| C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X
|
D
| D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体
|
E
| E元素的核电荷数等于A元素和B元素氢化物的核电荷数之和
|
?
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)。?
(2)E元素原子的核外电子排布式为 ?
(3)盐X的水溶液呈 (填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性 (填“强”或“弱”)。?
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是 ?
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ?,?
写出该阳离子与硫的氢化物的水溶液反应的离子方程式:?
参考答案:(1)>
(2)1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(3)酸性 强
(4)1∶2 NH3分子间存在氢键
(5)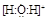 ?2H2O++H2S
?2H2O++H2S S↓+2H2O+2H+
S↓+2H2O+2H+
本题解析:根据题中A、B、C、D、E 的信息可确定A~E分别为O、Cl、N、C和Fe。(1)Y为P,P的价电子排布为3s23p3,为半充满状态,第一电离能小于Cl。
(2)Fe为26号元素,其核外电子排布式为1s22s22p63s23p63d64s2。
(3)盐为NH4NO3,属于强酸弱碱盐,因水解而显酸性;Cl的非金属性大于C,所以高氯酸酸性强于碳酸。
(4)N2分子含氮氮三键,σ键和π键的个数比为1∶2;由于分子间存在氢键,故使其沸点出现反常。
(5)H2O释放出一个电子生成H2O+,其中氧元素为-1价,具有强氧化性。
本题难度:一般