微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率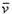 (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
[? ]
A.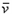 (NH3)=0.0101mol·L-1·s-1
(NH3)=0.0101mol·L-1·s-1
B.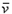 (O2)=0.0010 mol·L-1·s-1
(O2)=0.0010 mol·L-1·s-1
C. (NO)=0.0010 mol·L-1·s-1
(NO)=0.0010 mol·L-1·s-1
D. (H2O)=0.045 mol·L-1·s-1
(H2O)=0.045 mol·L-1·s-1
参考答案:C
本题解析:
本题难度:简单
2、填空题 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空
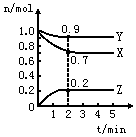
(1)该反应的化学方程式为________________。
(2)反应开始至2min,以气体Z表示的平均反应速率为________________。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的__________倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________(填“增大”“减小”或“相等”)。
参考答案:(1)3X+Y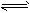 2Z
2Z
(2)0.05mol/(L·min)
(3)0.9;增大
本题解析:
本题难度:一般
3、选择题 对于N2(g)+3H2(g)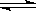 2NH3(g),不能作为反应达到平衡状态的判断依据是(?)
2NH3(g),不能作为反应达到平衡状态的判断依据是(?)
A.单位时间内生成1molN2,同时消耗3molH2
B.恒容密闭容器中总压强不变
C.生成氨气的速率与氨气分解的速率相等
D.N2、H2、NH3的浓度不再发生变化
参考答案:B
本题解析:可逆反应达到化学平衡状态的标志是正、逆反应速率相等、各组分浓度保持不变。单位时间内生成1molN2,为逆反应,同时消耗3molH2,为正反应,且v(正)=v(逆),A是平衡状态;反应正向进行时气体物质的量减小,定温、恒容密闭容器中气体的压强减小,所以压强不变不能说明反应达到平衡状态,需加定温条件,B错误;生成氨气的速率与氨气分解的速率相等即v(正)=v(逆),C是平衡状态;各组分浓度保持不变,说明反应达到平衡状态,D正确。
点评:理解化学平衡状态的直接标志(正、逆反应速率相等、各组分浓度保持不变)和间接标志(体系的压强、温度、颜色、平均摩尔质量等),但一定要分析清楚。
本题难度:一般
4、选择题 下列措施或事实不能用勒沙特列原理解释的是(?)
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知: 2NO2 (g) 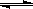 N2O4 (g))
N2O4 (g))
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D.煅烧粉碎的硫铁矿利于SO2的生成
参考答案:D
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系,因此选项A、B、C都可以用勒夏特列原理解释。选项D中的反应是燃烧,不是可逆反应,不能用勒夏特列原理解释,答案选D。
本题难度:一般
5、选择题 相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1
2XY3(g) ΔH=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器
编号
| 起始时各物质的物质的量/mol
| 达到平衡时体系能量的变化
|
X2
| Y2
| XY3
|
①
| 1
| 3
| 0
| 放热:23.15 kJ
|
②
| 0.6
| 1.8
| 0.8
| Q(Q>0)
|
?
下列叙述不正确的是(?)
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①的体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
参考答案:B
本题解析:平衡常数只与温度有关,温度不变,平衡常数不变,A项正确;由达平衡时①放出的热量为23.15 kJ,可知X2和Y2的转化率均为25%,即平衡时X2、Y2和XY3的物质的量分别为0.75 mol、2.25 mol和0.5 mol,此时XY3的物质的量浓度均为2 mol·L-1,可知②的反应应逆向进行,反应过程需要吸收热量,B项错误;两容器中反应达平衡时为等效平衡,故C项正确;增大压强平衡向正反应方向移动,放出热量多,D项正确。
本题难度:一般