| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《盐类水解的原理》高频考点强化练习(2017年最新版)(十)
参考答案:B 本题解析:Na2CO3是强碱弱酸盐,水解显碱性,NH4NO3强酸弱碱盐水解溶液显酸性; Na2SO4强酸强碱盐,不水解,溶液显中性,KNO3强酸强碱盐,不水解,溶液显中性,,选B。 本题难度:一般 2、填空题 (12分,每空2分)(1)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=6,试回答以下问题: |
 Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。 参考答案:(1)①NH4+ + H2O  NH3·H2O + H+ (2)10-6mol/L (3)C
NH3·H2O + H+ (2)10-6mol/L (3)C
(4)③> ②>① (5)氧化铁(6)5
本题解析:)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合,两者恰好完全反应生成NH4Cl,NH4Cl在水中完全电离产生:NH4+、Cl-,NH4+会水解:NH4+ + H2O  NH3·H2O + H+,使溶液中c(H+)>c(OH-),溶液呈酸性;水解促进了水的电离,则水电离出的c(OH-)= c(H+)=10-6mol/L;常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,可知溶液为NH4Cl和少量NH3·H2O的混合液,主体离子为NH4+、Cl-,次要微弱离子为H+、OH-,且存在电荷守恒:c(NH4+)+ c(H+)= c(Cl-)+ c(OH-),溶液呈中性即c(OH-)= c(H+),则c(NH4+)= c(Cl-),故C项正确;因为酸性强弱:CH3COOH>H2CO3>HCO3-,则水解程度大小关系为:CO32—> HCO3-> CH3COO—,故①CH3COONa ② NaHCO3 ③Na2CO3的碱性强弱为:③> ② >①;氯化铁溶液中存在水解平衡:FeCl3+3H2O
NH3·H2O + H+,使溶液中c(H+)>c(OH-),溶液呈酸性;水解促进了水的电离,则水电离出的c(OH-)= c(H+)=10-6mol/L;常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,可知溶液为NH4Cl和少量NH3·H2O的混合液,主体离子为NH4+、Cl-,次要微弱离子为H+、OH-,且存在电荷守恒:c(NH4+)+ c(H+)= c(Cl-)+ c(OH-),溶液呈中性即c(OH-)= c(H+),则c(NH4+)= c(Cl-),故C项正确;因为酸性强弱:CH3COOH>H2CO3>HCO3-,则水解程度大小关系为:CO32—> HCO3-> CH3COO—,故①CH3COONa ② NaHCO3 ③Na2CO3的碱性强弱为:③> ② >①;氯化铁溶液中存在水解平衡:FeCl3+3H2O Fe(OH)3+3HCl,加热水解平衡正向移动,且HCl挥发,故将氯化铁溶液蒸干则生成Fe(OH)3,灼烧2Fe(OH)3==Fe2O3+3H2O,故最后得到的固体是Fe2O3;在常温下Ksp(Cu(OH)2)=2×10-20可知向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,得:
Fe(OH)3+3HCl,加热水解平衡正向移动,且HCl挥发,故将氯化铁溶液蒸干则生成Fe(OH)3,灼烧2Fe(OH)3==Fe2O3+3H2O,故最后得到的固体是Fe2O3;在常温下Ksp(Cu(OH)2)=2×10-20可知向0.02 mol?L-1的CuSO4溶液中加入NaOH溶液,得: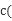 O
O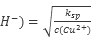 =10-9 mol/L,则溶液pH=5。
=10-9 mol/L,则溶液pH=5。
考点:弱电解质电离、水解平衡、难溶电解质溶解平衡。
本题难度:困难
3、选择题 下列反应中,属于水解反应且使溶液显酸性的是( ? )
A.CH3COOH+OH-?CH3COO-+H2O
B.HCO3-+H2O?CO32-+H3O+
C.S2-+H2O?HS-+OH-
D.NH4++H2O?NH3?H2O+H+
参考答案:D
本题解析:
本题难度:简单
4、选择题 关于溶液的下列说法正确的是( )
A.c(H+)
参考答案:
本题解析:
本题难度:困难
5、选择题 在0.1mol/L的Na2CO3的溶液中,下列关系式正确的是
A.c(Na+)>c(CO32-)> c(OH-)> c(H+)
B.c(OH-)= c(HCO3-)+ c(H2CO3)
C.2c(Na+)=c(CO32-)+ c(HCO3-)> c(H2CO3)
D.c(Na+)+ c(H+)= c(OH-) + c(HCO3-) +2c(CO32-)
参考答案:AD
本题解析:A、CO32?水解使溶液呈碱性,所以c(Na+)>c(CO32-)> c(OH-)> c(H+),正确;B、根据质子守恒可得:c(OH-)= c(HCO3-)+ 2c(H2CO3)+c(H+),错误;C、根据物料守恒可得c(Na+)="2" c(CO32-)+ 2c(HCO3-)+2 c(H2CO3),错误;D、根据电荷守恒可得:c(Na+)+ c(H+)= c(OH-) + c(HCO3-) +2c(CO32-),正确。
考点:本题考查离子浓度比较。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《键参数——.. | |