微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各物质投入水中,因促进水的电离而使溶液呈酸性的是?
A.HCl
B.NaHSO4
C.Na2SO4
D.NH4Cl
参考答案:D
本题解析:加入能水解的盐,促进水的电离。水解中谁强显谁性;故加入强酸弱碱盐,答案为D。
本题难度:简单
2、选择题 在0.01mol/L醋酸中加入少量硫酸后,其变化结果是(?)
A.氢离子浓度变小
B.醋酸分子的浓度减小
C.酸性减小,pH变大
D.醋酸根离子浓度变小
参考答案:D
本题解析:略
本题难度:简单
3、选择题 用水稀释0.lmol·L-1的氨水时,溶液中随着水量的增加而减小的是
A.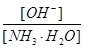
B.
C.[H+]和和[OH-]的乘积
D.OH-的物质的量
参考答案:B
本题解析:氨水中存在如下平衡: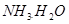 ?
?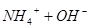 加水稀释,平衡将向右移动,所以A错,根据电离常数只受温度影响,只要温度不变电离常数不变,所以
加水稀释,平衡将向右移动,所以A错,根据电离常数只受温度影响,只要温度不变电离常数不变,所以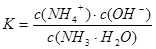 ,则
,则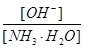
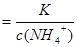
加水稀释,铵根离子浓度减小,比值增大;B正确;C错,[H+]和和[OH-]的乘积为水的离子积常数,只受温度影响;D错,加水稀释,平衡向右移动,氢氧根离子的物质的量增大;
本题难度:一般
4、选择题 现有室温下四种溶液,有关叙述不正确的是
编号
| ①
| ②
| ③
| ④
|
pH
| 11
| 11
| 3
| 3
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸溶液
| 盐酸
|
?
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③?
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va?L ④溶液与Vb?L ②溶液混合(近似认为混合溶液体积=Va + Vb),若混合后溶液
pH = 4,则Va?: Vb =" 11" : 9
参考答案:C
本题解析:A、醋酸是弱电解质,盐酸是强电解质,溶液pH=3,则c(CH3COOH)>c(HCl),消耗NaOH物质的量:③>④,正确;B、无论稀释多少倍,酸溶液pH<7,碱溶液pH>7,弱电解质溶液存在电离平衡,稀释时变化小一些,所以pH ①>②>④>③,正确;C、①、④两溶液等体积混合,所得溶液为大量一水合氨与少量氯化铵的混合液,且NH3·H2O电离程度大于NH4Cl的水解程度,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),错误;D、(Va ×10-3- Vb×10-3)/ Va + Vb=10-4,则Va?: Vb =" 11" : 9,正确。
本题难度:一般
5、选择题 下列说法正确的是
A.已知:2H2(g)+O2(g)=2H2O(l)△H<0,反应物总能量小于生成物总能量
B.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则1molH2SO4和1molBa(OH)2反应放出的热量为114.6kJ
D.已知C(s)与CO(g)的燃烧热分别为393.5kJ·mol-1 、283.0kJ·mol-1,则相同条件下C(s)与O2(g)反应生成1molCO(g)的反应热为△H=-110.5kJ/mol
参考答案:D
本题解析:
正确答案D
A.由反应:2H2(g)+O2(g)=2H2O(l)?△H<0,是放热反应,反应物总能量高于生成物总能量。
B.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂不可以是浓溶液,浓溶液稀释时也有热效应。
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则1molH2SO4和1molBa(OH)2反应放出的热量大于114.6kJ ,Ba2+与SO42―结合生成BaSO4时也要放热。
D.已知C(s)与CO(g)的燃烧热分别为393.5kJ·mol-1 、283.0kJ·mol-1,则相同条件下C(s)与O2(g)反应生成1molCO(g)的反应热为△H=-110.5kJ/mol
C(s)+O2(g)=CO2(g) △H1=―393.5kJ·mol-1
CO(g)+1/2O2(g)=CO2(g)?△H2=―283.0kJ·mol-1
由盖斯定律得C(s)+1/2O2(g)="CO(g)" △H=△H1―△H2=-110.5kJ/mol
本题难度:一般