微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法均摘自某科普杂志,你认为无科学性错误的是
A.铅笔芯的原料是金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
B.一氧化碳有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收一氧化碳,防止煤气中毒
C.“汽水”浇灌植物有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用
D.硅的提纯与应用,促进了半导体元件与集成芯片业的发展,硅也是光导纤维的主要成分
参考答案:C
本题解析:
本题难度:困难
2、选择题 常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4
参考答案:B
本题解析:试题分析:硫酸是二元强酸,溶液中氢离子的浓度是0.12mol/L,所以硫酸是过量的,则反应后溶液中氢离子的浓度是 ,所以pH=2,答案选B。
,所以pH=2,答案选B。
考点:考查pH的有关计算
点评:该题是高考中的常见题型,属于基础性试题的考查。该题难度不大,学生不难得分。该题的关键是首先判断出硫酸过量,然后直接列式计算即可。
本题难度:一般
3、选择题 某些芳香族化合物的分子式均为C7H8O,其中与FeCl3溶液混合后,显紫色和不显紫色的种类分别为
A.2种和1种
B.2种和3种
C.3种和2种
D.3种和1种
参考答案:C
本题解析:
本题难度:简单
4、选择题 对电解水的叙述正确的是
A.水能转化为化学能
B.电能转化为化学能
C.电能转化为机械能
D.电能转化为热能
参考答案:B
本题解析:由2H2O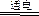 2H2↑+O2↑即知。
2H2↑+O2↑即知。
本题难度:一般
5、填空题 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2) H2O以 键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(4)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.Cl2+H2O=HCl+HClO
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2