微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 自然界里常见金属元素存在最多的是Al,其次是铁,而铜的含量较少。但是人类冶炼金属获得成功最早的反而是含量少的铜,含量最多的铝最迟冶炼出来,究其原因,下列说法中合理的是
A.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发
B.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现
C.铜矿较易还原,铝矿很难还原
D.以上说法是错误的
参考答案:C
本题解析:自然界中铝的含量比铜多,但铜的使用比铝早,原因是铝比铜活泼,铜易冶炼而铝不易冶炼。
点评:金属活动性顺序表中,K、Ca、Na、Mg、Al一般用电解法冶炼;Zn、Fe、Sn、Pb、Cu一般用还原法冶炼;Hg、Ag一般用加热法冶炼。
本题难度:一般
2、选择题 当向下列各组溶液中分别通入CO2后,可能产生白色沉淀的是( )
①澄清石灰水②CaCl2溶液③Ca(HCO3)2溶液④CaCl2和氨水的混合溶液.
A.①④
B.②③
C.①③
D.①②
参考答案:A
本题解析:
本题难度:简单
3、填空题 (16分)蛇纹石因其花纹似蛇皮而得名,某地蛇纹石大约含MgO38%,另外除了含SiO2外,还含有CaO、Fe2O3、Al2O3等氧化物,由蛇纹石矿制备MgO的工艺流程如下。
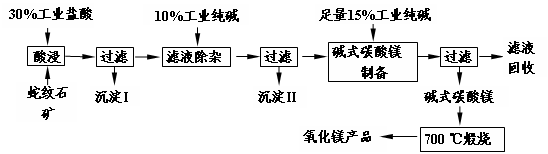
(1)写出酸浸过程中的一个离子方程式?。若在实验室进行酸浸过程,需要的仪器有烧杯、?。
(2)沉淀I的成分是?(写化学式)。写出它的一个用途?。
(3)沉淀II的成分是?。
(4)从滤液中能回收的物质有?。
(5)写出碱式碳酸镁700 ℃煅烧产生氧化镁的化学方程式?。
参考答案:(1)MgO+2H+=Mg2++H2O;或CaO+2H+=Ca2++H2O;或Fe2O3+6H+=2Fe3++3H2O;
或Al2O3+6H+=2Al3++3H2O(任写一个,2分)?
玻璃棒?(2分)
(2)SiO2?制取(水)玻璃、光纤等(各2分)?
(3)CaCO3、Fe(OH)3、Al(OH)3;或Ca、Fe、Al等的碱或碳酸盐沉淀(3分)?
(4)NaCl、Na2CO3、NaHCO3(各1分,共3分)?
(5)Mg2(OH)2CO3 2MgO+CO2↑+H2O↑
2MgO+CO2↑+H2O↑
或aMgCO3·bMg(OH)2 (a+b)MgO+aCO2↑+bH2O↑(2分)
(a+b)MgO+aCO2↑+bH2O↑(2分)
本题解析:(1)根据矿石中的成分可知只有SiO2和盐酸不反应,其它氧化物均和盐酸反应。为了加快反应的进行,在反应过程中需要用玻璃棒不断的搅拌。
(2)SiO2不溶于水,通过过滤即得到。二氧化硅的主要用途是制造光导纤维或制取玻璃等。
(3)滤液中的金属阳离子有Mg2+、Ca2+、Fe3+、Al3+,加入过量的纯碱Na2CO3可以生成CaCO3、Fe(OH)3、Al(OH)3沉淀。
(4)当把碱式碳酸镁过滤之和,根据原子守恒可知滤液中的主要物质是氯化钠、碳酸钠和碳酸氢钠。
(5)碱式碳酸镁在加热的条件下分解生成氧化镁、CO2和水。
本题难度:一般
4、填空题 锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:

(1)酸浸时,二氧化锰被双氧水还原的化学方程式为_______。
(2)活性铁粉除汞时,铁粉的作用是______ (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液进行吸收而实现的。如下图是KMnO4溶液处于不同pH时对应的Hg去除率变化图,图中物质为Hg与 MnO4-在该pH范围内的主要产物。
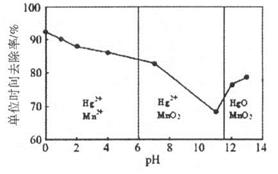
①请根据该图给出pH对汞去除率影响的变化规律:______。
②试猜想在强酸性环境下汞的单位时间去除率高的原因:______。
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成____________。
(5)经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是______。
参考答案:(15分)(1)MnO2 + H2O2 + H2SO4=MnSO4 +O2↑ + 2H2O(3分)(2)还原剂(2分)
(3)①随pH的升高汞的去除率先降低后增加(2分)
②Mn2+具有催化作用,单位时间内去除率高(2分)
(4)MnO·4ZnO·5Fe2O3(3分)
(5)调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成(3分)
本题解析:(1)二氧化锰被双氧水还原,说明二氧化锰是氧化剂,得到电子。双氧水是还原剂失去电子,其氧化产物是氧气,所以反应的化学方程式为MnO2 + H2O2 + H2SO4=MnSO4 +O2↑ + 2H2O。
(2)铁是活泼的金属,所以活性铁粉除汞时,铁粉的作用是还原剂。
(3)①根据图像可知,随着pH的升高汞的去除率先降低后增加。
②根据图像可知,在强酸性条件下,MnO4-的还原产物是Mn2+,Mn2+具有催化作用,所以单位时间内去除率高。
(4)当x=0.2时,该物质的化学式可表示为Mn0.2Zn0.8Fe2O4,即Mn、Zn、Fe的原子个数之比=1:4:10,所以用氧化物形式可表示为MnO·4ZnO·5Fe2O3。
(5)根据锰锌铁氧化体组成可知,加入一定量的MnSO4和铁粉可以调节滤液离子的成分,使其符合水热后获得锰锌铁氧化体组成
本题难度:一般
5、选择题 在制取水泥、玻璃的生产中,共同使用的主要原料是
[? ]
A.Na2CO3
B.石灰石
C.石英
D.黏土
参考答案:B
本题解析:
本题难度:简单