微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:?
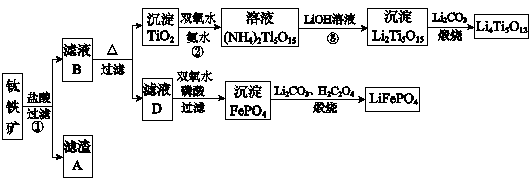
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是?。
(2)滤渣A的成分是?。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是?。
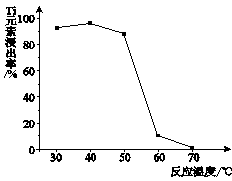
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是?。
(5)反应③的化学方程式是?。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是?。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4
Li7Ti5O12+3FePO4
该电池充电时阳极反应式是?。
参考答案:(12分,每空2分)
(1)+2
(2)SiO2
(3)TiOCl42-+H2O  TiO2↓+2H++4Cl-
TiO2↓+2H++4Cl-
(4)温度过高时,反应物氨水(或双氧水)受热易分解
(5) (NH4)2Ti5O15+2LiOH=Li2Ti5O15↓+2NH3·H2O(或2NH3+2H2O)
(6)20/9(1分)
(7)LiFePO4 – e-=FePO4+Li+(1分)
本题解析:(1)根据题目所给信息:可表示为FeO·TiO2,可知Fe的化合价为:+2。
(2)FeTiO3、MgO、CaO与HCl反应,剩下的固体只有SiO2。
(3)过滤后未加其他反应物,所以TiOCl42-与H2O反应,生成TiO2,同时生成H+、Cl?。
(4)TiOCl42- 转化为TiO2时,需要加入反应物双氧水、氨水,这两种物质受热易分解。
(5)(NH4)2Ti5O15为铵盐,LiOH为强碱,发生复分解反应,根据反应规律,即可写出化学方程式。
(6)分析反应流程,H2O2把Fe2+氧化为Fe3+,H2C2O4把Fe3+还原为Fe2+,H2O2中O由-1价变为-2价,H2C2O4由+3价变为+4价,根据电子转移总数相等得:m(H2O2)×17÷200g/mol×2=m(H2C2O4)÷90g/mol×2,得m(H2O2):m(H2C2O4)= 20/9。
(7)电池充电时阳极反应为失电子反应,LiFePO4中Fe失去1个电子,由+2价变为+3价,生成FePO4,同时得到Li+。
本题难度:困难
2、简答题 氮化硅Si3N4是一种非氧化物高温陶瓷结构材料.粉末状的Si3N4可以由SiCl4的蒸气和NH3气的混合物反应制取.粉末状Si3N4对空气和水都不稳定,粉末状Si3N4遇水能生成一种有刺激性气味、常用做制冷剂的气体和一种难溶性的酸;粉末状Si3N4与空气接触能产生N2和另外一种物质.但是,将粉末状Si3N4和适量MgO(难熔)在230℃1.01×105Pa和185℃的密闭容器中热处理,可以得到结构十分紧密、对空气和水都相当稳定的固体材料.
(1)写出由SiCl4和NH3制备Si3N4的反应方程式:______.
(2)分别写出粉末状Si3N4和H2O及O2反应的方程式:______;______.
(3)为什么结构紧密的固体Si3N4不再受H2O和O2的侵蚀?
参考答案:(1)SiCl4的蒸气和NH3的混合物反应生成Si3N4,其化学方程式为:3SiCl4+4NH3═Si3N4+12HCl;故答案为:3SiCl4+4NH3═Si3N4+12HCl;
(2)粉末状Si3N4遇水能生成一种有刺激性气味、常用做制冷剂的气体是氨气和一种难溶性的酸是硅酸,其反应方程式为:Si3N4+9H2O═3H2SiO3+4NH3;粉末状Si3N4与空气接触能产生N2和另外一种物质,根据原子守恒可知为二氧化硅,其反应方程式为Si3N4+3O2═3SiO2+2N2;
故答案为:Si3N4+9H2O═3H2SiO3+4NH3;Si3N4+3O2═3SiO2+2N2;
(3)因为在加压和加热条件下Si3N4颗粒表面生成了SiO2,与MgO一起形成致密的氧化物保护膜,使固体Si3N4不再受H2O和O2的侵蚀;
故答案为:在加压和加热条件下Si3N4颗粒表面生成了SiO2,与MgO一起形成致密的氧化物保护膜.
本题解析:
本题难度:一般
3、填空题 选修:化学与技术】(金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:
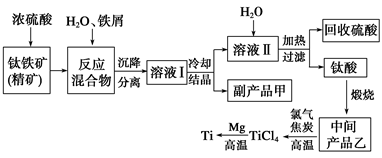
已知反应:①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)△TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O△TiO2·nH2O+H2SO4。
请回答下列问题:
(1)副产品甲是____________,可循环利用的物质是___________________________。
(2)上述生产流程中加入铁屑的目的是_______________________________________。
(3)写出中间产品乙与焦炭、氯气在高温下发生反应的方程式为:________________。
(4)“硫酸法”生产钛排放的废液对水体有哪些污染,请指出主要的两点:
①_________________________________;②_______________________________。
针对其中一项污染,提出处理的方法:?。
参考答案:(1)FeSO4·7H2O(名称、俗名亦可) 硫酸(H2SO4)
(2)防止Fe2+被氧化(合理答案均计分)
(3)TiO2+2Cl2+2C高温TiCl4+2CO(3分)(写CO2也给分)
(4)①酸污染?②重金属离子(Cu2+、Cr3+等)污染(合理答案均计分)
中和法、沉淀法(合理答案均计分)
本题解析:(1)从流程图硫酸与过量的铁反应可知,副产品甲是FeSO4·7H2O,可循环利用的物质是硫酸。
(2)生产流程中加入铁屑的目的是防止Fe2+被氧化;
(4)“硫酸法”是酸性,会产生酸污染;与Ti共存的其它重金属的废液对水 体有污染。
产生酸污染可以加入石灰中和,重金属离子污染可通过沉淀法除去。
本题难度:困难
4、选择题 在熔融状态下,Na与KCl存在可逆反应:Na+KCl NaCl+K,通过调整温度,可利用金属Na来制取K。
NaCl+K,通过调整温度,可利用金属Na来制取K。
物质
| K
| Na
| KCl
| NaCl
|
熔点(℃)
| 63.6
| 97.8
| 770
| 801
|
沸点(℃)
| 774
| 883
| 1 500
| 1 413
|
?
根据上表的熔点和沸点,确定由Na与KCl反应制取K的合适温度为(?)
A.770℃?B.801℃
C.850℃?D.770℃~801℃
参考答案:C
本题解析:K、Na的活泼性相近,要从上述可逆的置换反应中制取K,主要是利用K的沸点比Na的低而控制温度使K气化。其余三种物质均为液体,便于生成的K蒸气不断逸出,使反应向生成K的方向进行而制得K。应在801℃~883℃间合理。
本题难度:一般
5、填空题 功能高分子材料是指既具有传统高分子材料的机械功能,又具有某些_______的高分子材料,常见的功能高分子材料有 __________、____________、_____________等。
参考答案:独特功能 ;强吸水性树脂 ;高分子分离膜 ;医用高分子材料
本题解析:
本题难度:简单