|
高考化学知识点总结《电解池原理》答题技巧(2017年最新版)(四)
2017-07-27 09:37:59
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图为阳离子交换膜法电解饱和食盐水原理示意图.?下列说法不正确的是( )
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4LC12,便产生2molNaOH
D.粗盐水中含Ca2+、Mg2+、Fe2+、SO42-等离子,精制时最先加Na2CO3溶液
| 
参考答案:A、在电解池中,钠离子移向阴极,所以D极是阴极,该极除了产生氢氧化钠以外还会产生氢气,故从E口逸出的气体是H2,故A正确;
B、阴极D极产生大量的氢氧化钠,为了增强导电性,可以从B口加入含少量NaOH的水溶液,故B正确;
C、电解原理方程式2NaCl+2H2O?通电?.?2NaOH+Cl2↑+H2↑,标准状况下每生成22.4L即1molC12,便产生2molNaOH,故C正确;
D、粗盐的提纯要加入氯化钡、氢氧化钠、碳酸钠,但是碳酸钠一定要加在氯化钡的后面,出去过量的钡离子,故D错误.
故选D.
本题解析:
本题难度:简单
2、计算题 在500 g CuSO4溶液中插入两根电极,一根为铁,一根为含杂质锌均匀的粗铜。通电一段时间后切断电源,立即将电极取出,这时铁极上析出7.04 g铜,电解质溶液增重0.02 g。求粗铜中含锌的质量分数。
参考答案:18.4%
本题解析:铁上有Cu析出,说明铁为阴极,粗铜为阳极。
阴极:Cu2++2e- Cu Cu
阳极:Cu-2e- Cu2+? Zn-2e- Cu2+? Zn-2e- Zn2+ Zn2+
因溶液增重0.02 g,则:
Zn? —? Cu?Δw
65g? 64g? 1g
1.3g?1.28g?0.02g
可知溶解的粗铜中含Zn1.3g,含Cu7.04g-1.28g=5.76g,所以
w(Zn)= 。 。
本题难度:一般
3、选择题 用阳极a和阴极b电解c的水溶液一段时间,然后加入d,能使溶液恢复到电解前状态,a、b、c、d正确组合是( )。
选项
| a
| b
| c
| d
| A
| Pt
| Pt
| NaOH
| NaOH
| B
| C
| C
| NaCl
| NaOH
| C
| Cu
| Cu
| CuSO4
| Cu(OH)2
| D
| Pt
| Pt
| H2SO4
| H2O
|
?
参考答案:D
本题解析:A项和D项中,实质为电解水,故应加水复原;B项中,电解反应式:2NaCl+2H2O Cl2↑+H2↑+2NaOH从溶液中析出Cl2、H2,二者合成HCl,复原措施为通入HCl气体;C项中,阳极为Cu,电解质溶液为CuSO4溶液,故为电镀装置,电解质溶液浓度和成份均未改变。 Cl2↑+H2↑+2NaOH从溶液中析出Cl2、H2,二者合成HCl,复原措施为通入HCl气体;C项中,阳极为Cu,电解质溶液为CuSO4溶液,故为电镀装置,电解质溶液浓度和成份均未改变。
本题难度:一般
4、选择题 下列叙述正确的是
A.用惰性电极电解滴有紫色石蕊试液的饱和食盐水,阴极区附近溶液先变红
B.镀锌的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
C.用惰性电极电解CuSO4溶液,在电解后溶液中加Cu(OH)2固体能使CuSO4溶液恢复到电解前浓度
D.若要在一些金属制品表面镀一层银,则以待镀金属制品作阴极,银作阳极,含有银离子的溶液作电解质溶液网
参考答案:D
本题解析:略
本题难度:简单
5、选择题 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是
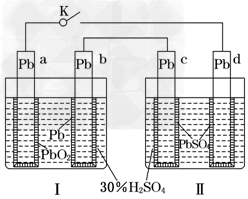
[? ]
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO42-
B.当电路中转移0.2?mol电子时,Ⅰ中消耗的H2SO4为0.2?mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,?Ⅱ可单独作为原电池,d电极为正极
参考答案:C
本题解析:
本题难度:一般
| 