微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):
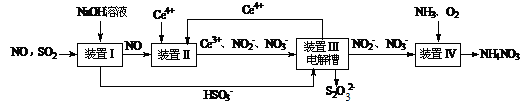
⑴装置Ⅰ中的主要离子方程式为 。3
⑵含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
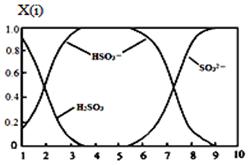
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
⑶写出装置Ⅱ中,酸性条件下的离子方程式 。
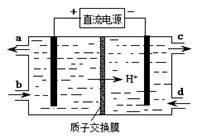
⑷装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
①生成Ce4+从电解槽的 (填字母序号)口流出。②写出与阴极的反应式 。
⑸已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示, 计算结果保留整数)
参考答案:(1) SO2+OH-=HSO3-;
(2) ①c(Na+)
本题解析:
本题难度:一般
2、选择题 电解尿素[ CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。下列说法正确的是
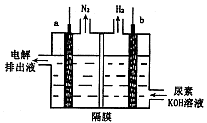
A.电解时,b极是阴极放出H2,发生氧化反应
B.溶液中OH—逐渐向b极移动
C.电解时,a极的电极反应式为: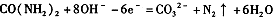
D.若在b极产生标况下224mL氢气,则消耗尿素2g
参考答案:C
本题解析:A中电解时,b极是阴极放出H2,发生还原反应,错误;B中溶液中OH—逐渐向阳极a极移动,错误;C正确;D由电子守恒得:CO(NH2)2~3H2,生成H2 0.01mol,则消耗尿素0.01/3 mol,为0.2g,错误。
本题难度:一般
3、填空题 (6分)电解原理在化学工业上有着广泛的应用。图中电解池a为电解液,X和Y是两块电极板。则:
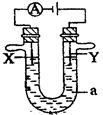
(1)若X和Y均为惰性电极,a为饱和的NaCI溶液,则电解时检验Y电极反应产物的方法是 。
(2)若X、Y分别为石墨和铁,A乃为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象为 。
(3)若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
参考答案:(1)将湿润的淀粉碘化钾试纸靠近Y及支管口,试纸变蓝,说明有氯气生成
(2)白色固体迅速变为灰绿色,最终变为红褐色? (3)0.4 mol
本题解析:(1)Y是阳极产物,所以Y是氯气,极易氯气可以利用其氧化性,即将湿润的淀粉碘化钾试纸靠近Y及支管口,试纸变蓝,说明有氯气生成。
(2)此时铁是阳极,所以铁失去电子,生成亚铁离子。阴极氢离子放电,从而产生氢氧化钠,进而生成氢氧化亚铁沉淀。氢氧化亚铁不稳定,极易被氧 气氧化生成氢氧化铁,所以现象就是白色固体迅速变为灰绿色,最终变为红褐色。
(3)向所得溶液中加入0.1 mol Cu(OH)2,恰好恢复电解前的浓度和pH,说明反应中阴极是铜和氢气,阳极生成氧气,根据原子守恒可知,氧气是0.1mol,所以转移电子是0.1mol×4=0.4mol。
本题难度:一般
4、选择题 关于如图装置说法正确的是
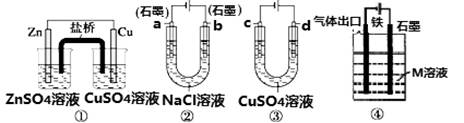
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的OH-的浓度增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中若M是海水,该装置是通过“牺牲阳极保护法”使铁不被腐蚀