微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 不能用排水集气法收集的气体是
A.02
B.HCl
C.H2
D.NO
参考答案:B
本题解析:氯化氢极易溶于水,所以不能用排水法收集,其余都是可以的,答案选B。
点评:点评:气体的收集方法是:1.排水法适用于不易溶于水的气体。例如氢气,氧气。2,向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气。3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。
本题难度:简单
2、实验题 如下图所示,室温下向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2(所有气体体积均在标准状下测定)。
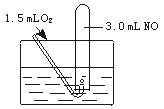
试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①_______________________________;
②_______________________________;
③_______________________________。
(2)最终试管中剩余的气体是_________,体积为_________。
参考答案:(1)①通入O2,试管内气体变为红棕色②试管内液面升高③最后试管内剩余一种无色气体
(2)NO? 1.0 mL
本题解析:(1)通入的O2与NO发生反应生成NO2:
①2NO+O2=2NO2
所以看到有红棕色气体生成.生成的NO2溶于水:
②3NO2+H2O =2HNO3+NO
①②两反应的总方程式为:
③4NO+3O2+2H2O =4HNO3
气体被消耗,所以又会看到试管内液面上升.V(NO)∶V(O2)≠4∶3,故最后有气体剩余,不论剩余NO还是O2,都为无色气体,这是看到的第三个现象。
(2)设1.5 mL O2全部参加反应,由(1)中③知:
V反应(NO)=V反应(O2)×4/3=1.5 mL×4/3=2.0 mL
而NO的总体积是3.0 mL,故剩余NO气体1.0 mL。
本题难度:简单
3、填空题 现配制500mL0.5moI/L的NaOH溶液
(1)需要的仪器除用量筒、烧杯、玻璃棒外,(2)还需要的玻璃仪器有__________.
(3)用托盘天平称量氢氧化钠固体时,?(4)应在小烧杯里应称量___克氢氧化钠.
(5)配制过程主要有:溶解、_____、转移、______、加水稀释、定容、摇匀,而
(6)后转移到试剂瓶里并贴上标(7)?签。(8)若取上述溶液100mL,(9)其物质的量浓度为________(10)如果其它各项操作均正常,(11)?仅有一项下列操作时,(12)对配制结果有何影响(填偏高、偏低、无影响或无法确定)?定容时俯视刻度线________.配制前容量瓶不干燥_______.定容后摇匀时有液体贱出______.
参考答案:(1)500mL的容量瓶和胶头滴管,(2)10.0 (3)冷却、洗涤
(4)0.5moI/L?(5)偏高、无影响、无影响
本题解析:略
本题难度:简单
4、填空题 下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是
A.SO2、H2S、Cl2
B.SO2、O2、NH3
C.SO2、CO2、O2
D.HCl、H2S、HI
参考答案:C
本题解析:A中三者不能共存(因:SO2+2H2S=3S+2H2O H2S+Cl2=S+2HCl),且H2S不能用浓硫酸干燥(因H2S具还原性,浓硫酸有强氧化性,所以H2S能被浓硫酸氧化);
B中SO2、NH3不能共存(因两者能发生反应),NH3不能用浓硫酸干燥(因2NH3+H2SO4=(NH4)2SO4);
D中三者能共存,但H2S、HI不能用浓硫酸干燥(原因同A,发生氧化还原反应);
本题难度:一般
5、实验题 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
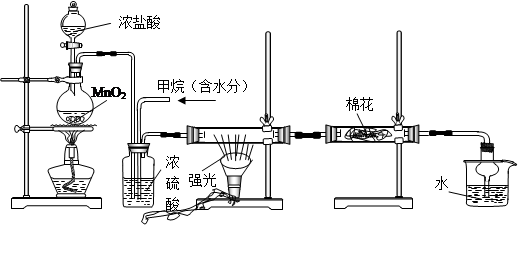 ?
?
A? B? C? D? E
(1)写出A装置中发生反应的离子方程式??
(2)B装置主要有三种功能:①?②?③均匀混合气体;
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的值应≥?
(4)D装置中棉花上均匀滴有足量淀粉KI浓溶液,其作用是?,一段时间后发现
棉花由白色变为?色。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式?。
(6)E装置中使用球形干燥管的作用是?
(7)E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为?(填字母)。
A.分液法
B.蒸馏法
C.过滤
D.结晶法
参考答案:(1)MnO2+4H+ +2Cl- Mn2++Cl2↑+2H2O? (2分)
Mn2++Cl2↑+2H2O? (2分)
(2)①干燥混合气体②控制气流速度
(3)4
(4)吸收过量的氯气?蓝色
(5)CH4+2Cl2 C+4HCl
C+4HCl
(6)防倒吸
(7)A
本题解析:
 试题分析:(1)结合所给药品分析,装置A是实验室制备氯气的反应,离子反应为:MnO2+4H+ +2Cl-? Mn2++Cl2↑+2H2O?。(2)甲烷的取代反应需要纯净的氯气,瓶中装浓硫酸有干燥气体的作用,将两种气体在瓶中混匀,有缓冲、控制气流的作用。(3)1摩尔氯气参加反应只能取代1摩尔氢原子,要获得最多的氯化氢,将甲烷中的4个氢原子全部取代,最少需要4体积氯气。(4)吸收过量的氯气生成碘单质,遇淀粉变为蓝色。(5)CH4+2Cl2
试题分析:(1)结合所给药品分析,装置A是实验室制备氯气的反应,离子反应为:MnO2+4H+ +2Cl-? Mn2++Cl2↑+2H2O?。(2)甲烷的取代反应需要纯净的氯气,瓶中装浓硫酸有干燥气体的作用,将两种气体在瓶中混匀,有缓冲、控制气流的作用。(3)1摩尔氯气参加反应只能取代1摩尔氢原子,要获得最多的氯化氢,将甲烷中的4个氢原子全部取代,最少需要4体积氯气。(4)吸收过量的氯气生成碘单质,遇淀粉变为蓝色。(5)CH4+2Cl2 C+4HCl 。(6)氯化氢极易溶于水,连接干燥管可防止倒吸。(7)制得的盐酸中混有不溶于水的卤代烃,分液可分离。
C+4HCl 。(6)氯化氢极易溶于水,连接干燥管可防止倒吸。(7)制得的盐酸中混有不溶于水的卤代烃,分液可分离。
本题难度:困难