|
高考化学知识点整理《有关氧化还原反应的计算》试题预测(2017年最新版)(十)
2017-07-27 09:50:25
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下:
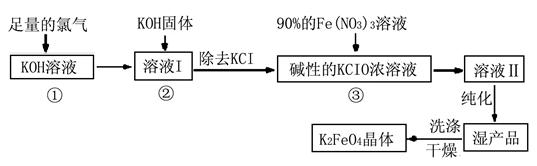
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式 。
(2)在溶液I中加入KOH固体的目的是 (选填序号)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度
| (3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。要制得69.3克K2FeO4,理论上消耗氧化剂的物质的量为 mol。
(4)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O, 3Zn+2K2FeO4+8H2O,
放电时电池的负极反应式为 。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,用作火箭燃料。
(5)写出肼分子的电子式 。
(6)肼能与N2O4反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol, 写出肼与O2反应生成N2和H2O(g)的热化学方程式 。
参考答案:I.(1)2OH-+Cl2=ClO-+Cl-+H2O;(2)AC;
(3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 0.525;
(4)Zn+2OH--2e-=Zn(OH)2 [或 Zn+2OH-=Zn(OH)2+2e- 或3Zn+6OH---6e-=3Zn(OH)2]
II.(5)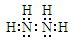
(6)N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol
本题解析:(1)KOH与Cl2发生反应同NaOH与Cl2发生反应产物为KCl和KClO。
(2)在溶液I中加入KOH固体一方面为下一步反应提供碱性的环境;另一方面与溶液I中过量的Cl2继续反应,生成更多的KClO。故AC正确。
(3)反应③从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,说明Fe3+—→FeO42-、ClO-—→Cl-,即2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;由3KClO~2K2FeO4,制得69.3克K2FeO4,理论上消耗n(KClO)为0.525mol。
(4)放电时活泼金属Zn是电池的负极,碱性环境,则反应式为Zn+2OH--2e-=Zn(OH)2。
(5)写肼分子的电子式注意N-N是一对电子共用。
(6)根据要求写出化学反应N2H4(g)+O2(g)=N2(g)+2H2O(g),由盖斯定律可知,ΔH为已知两个反应的和的一半。
考点:以化工流程为载体,考查氧化还原反应的书写、电极反应式的书写;电子式、热化学方程式的书写等化学用语。
本题难度:困难
2、选择题 下列有关化学用语或化学模型正确且能确定为对应物质的是
A.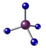 ---甲烷 ---甲烷
B. -------二氧化碳 -------二氧化碳
C. ----次氯酸 ----次氯酸
D.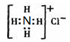 ------NH4C1 ------NH4C1
参考答案:C
本题解析:A不正确,因为和 碳原子相连的原子的原子半径不相同,不是甲烷。B不正确,因为碳原子的半径大于氧原子的。氯化铵是离子化合物,电子式为 。答案选C。 。答案选C。
本题难度:一般
3、简答题 (1)若要配制100mL0.1mo1?L-1Na2SO4溶液,需称量Na2SO4的质量为______g.
(2)将2240mL氨完全溶于水配成100mL溶液,氨水中NH3的物质的量浓度为______mol?L-1.(不考虑NH3与H2O的反应)
(3)实验室里常用固体氯化铵与足量熟石灰加热制取氨.若需要2240mL(标准状况)氨,求至少需要氯化铵的质量.
参考答案:(1)配制100mL0.1mo1?L-1Na2SO4溶液,需称量Na2SO4的质量为:0.1L×0.1mol/L×142g/mol≈1.4g,故答案为:1.4;
(2)2240mL氨气的物质的量为:2.24L22.4L/mol=0.1mol,
氨水的物质的量浓度为:0.1mol0.1L=1mol/L,
故答案为:1;
(3)令生成2240mL(标准状况)氨气需要氯化铵的质量为mg,则:
2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O
107g? 44.8L
mg? 2.24L
所以107g:mg=44.8L:2.24L
解得:m=5.35
答:需要氯化铵5.35g.
本题解析:
本题难度:一般
4、选择题 在给定条件下,下列划线的物质在化学反应中能被完全消耗的是( )
A.在适当温度和催化剂作用下,用2molSO2和1molO2合成SO3
B.标准状况下,将1g铝片投入20mL18mol?L-1的硫酸中
C.常温下,向100mL3mol?L-1的硝酸中加入6.4gCu
D.将含有少量H2O(g)的H2通入足量Na2O2容器中并不断用电火花点燃
参考答案:A、二氧化硫和氧气反应生成三氧化硫的反应是可逆反应,存在反应限度,不能完全反应,故A错误.
B、18mol/L的浓硫酸在标况下能与Al发生钝化,生成的致密氧化物薄膜阻止反应的进一下发生,则Al不会被完全反应掉,故B错误.
C、n(Cu)=6.4g64g/mol=0.1mol,n(HNO3)=0.1mL×3mol?L-1=0.3mol,根据方程式3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,0.1molCu完全反应需硝酸0.8mol,所以Cu有剩余,故C错误.
D、由于电火花的引燃,氢气与生成的氧气反应生成水,水再与过氧化钠反应生成氧气,如此循环反应,相当于H2与Na2O2反应生成NaOH,过氧化钠足量,所以氢气完全反应,故D正确.
故选:D.
本题解析:
本题难度:一般
5、选择题 下列化学用语表示正确的是
A.CO2分子的比例模型示意图: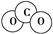
B.三氟化氮的电子式: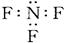
C.二氧化硅的分子式:SiO2
D.含有10个中子的氧原子: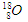
参考答案:D
本题解析:CO2分子的比例模型为 。三氟化氮中每个氟原子还有3对电 。三氟化氮中每个氟原子还有3对电
子对没有参与成键,正确的为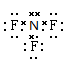 。在二氧化硅中不存在分子,SiO2代表化学式。所以正 。在二氧化硅中不存在分子,SiO2代表化学式。所以正
确的答案是D。
本题难度:简单
|  3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,