| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《难溶电解质的溶解平衡》试题强化练习(2017年最新版)(二)
参考答案:18.(普通班) (15分) 本题解析:(1)AgBr固体在水中达到溶解平衡,表达式为AgBr(s) 本题难度:困难 3、填空题 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
请回答下列问题: (1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。 A. MgO B. Na2CO3 C. 蒸馏水 (2)Fe2+与H2O2溶液反应的离子方程式为 。 (3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如右图所示。 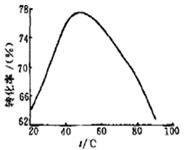 ①步骤III中制备氢氧化镁反应的离子方程式为 。 ②根据图中所示50 ℃前温度与Mg2+转化率之间 的关系,可判断此反应是 (填“吸热”或“放热”)反应。 ③图中,温度升高至50 ℃以上Mg2+转化率下降的可能原因是 。 ④ Ksp表示沉淀溶解平衡的平衡常数。已知: Mg(OH)2(s)  Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12Ca(OH)2(s)  Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6 Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。 参考答案:(14分)(1)A (2分) 本题解析:(1)步骤II中,可用于调节溶液pH至7~8的目的是和酸反应提高溶液pH,使Fe3+、Al3+等杂质离子沉淀分离除去, 本题难度:困难 4、选择题 对于表达式PbI2(s) 参考答案:BD 本题解析:此题主要考查沉淀溶解平衡表达式的书写及其与电离平衡的区别。在书写沉淀溶解平衡表达式时,要特别注明沉淀的状态(s)及生成离子的状态(aq),这是它与电离方程式最大的不同这处,在判断时一定要看清楚。故A.C错误,B.D正确。 本题难度:一般 5、实验题 下列实验装置、操作能达到实验目的的是 参考答案:D 本题解析:A中烧杯没用纸板盖住,热量损失太多,A错;B中AgI的溶解度比AgCl,溶解度小的沉淀不能转化溶解度大的,B错;粗铜的精炼时粗铜做阳极,精铜做阴极,C错;D对。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《认识晶体》.. | |