微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl的溶解度减小
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变
参考答案:A
本题解析:AgCl固体在溶液中存在溶解平衡,当达到溶解平衡时,AgCl固体生成Ag+和Cl-的速率必然等于Ag+和Cl-结合成AgCl固体的速率,A正确;没有绝对不溶的物质,B错误;一般说来,温度升高,固体的溶解度增大,C错误,但少数固体的溶解度随温度升高而降低,如Ca(OH)2;向AgCl沉淀的溶解平衡体系中加入NaCl固体,增大了c(Cl-),平衡向左移动,AgCl的溶解度减小,D错误。
本题难度:一般
2、选择题 已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,下列叙述正确的是(?)
A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C.向0.0008 mol·L- 1的K2CrO4溶液中加入等体积的0.002mol/LAgNO3 溶液,则CrO42-完全沉淀
D.将0.001 mol·L- 1的AgNO3 溶液滴入0.001 mol·L- 1的KCl和0.001 mol·L- 1的K2CrO4溶液,则先产生AgCl沉淀
参考答案:D
本题解析:饱和AgCl溶液中c(Ag+)=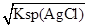 =1.56×10-10mol/L,饱和Ag2CrO4溶液中c(Ag+)=
=1.56×10-10mol/L,饱和Ag2CrO4溶液中c(Ag+)=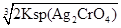 ,显然后者的c(Ag+)大,A错误;AgCl的Ksp只与温度有关,向AgBr的浊液中加入溴化钠溶液,虽然平衡向逆方向移动,但Ksp不变,B错误;两溶液混合后则c(K2CrO4)=0.0004 mol/L,c(AgNO3)=0.001 mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001-0.0004×2=0.0002 mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)=
,显然后者的c(Ag+)大,A错误;AgCl的Ksp只与温度有关,向AgBr的浊液中加入溴化钠溶液,虽然平衡向逆方向移动,但Ksp不变,B错误;两溶液混合后则c(K2CrO4)=0.0004 mol/L,c(AgNO3)=0.001 mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001-0.0004×2=0.0002 mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)=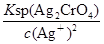 =
=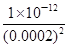 =2.5×10-5mol/L<1.0×10-5mol/L,故c(CrO42-)不能完全沉淀, C错误;根据Ksp (AgCl)、Ksp (Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=
=2.5×10-5mol/L<1.0×10-5mol/L,故c(CrO42-)不能完全沉淀, C错误;根据Ksp (AgCl)、Ksp (Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=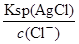 =1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=
=1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=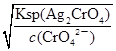 =4.36×10-5 mol/L,故先产生AgCl沉淀,D正确。
=4.36×10-5 mol/L,故先产生AgCl沉淀,D正确。
点评:该题是高考中的常见题型,属于中等难度的试题,该题既有定性的分析,也有定量的计算,有利于培养学生分析问题、解决问题的能力。
本题难度:简单
3、填空题 氯化亚铜(CuCl)在石油工业生产中常用作脱硫剂和脱色剂.工业生产氯化亚铜的一种工艺流程如图所示:
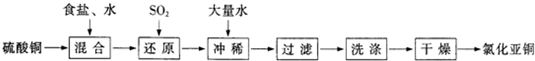
已知:①CuCl难溶于水和乙醇,干燥的CuCl在空气中比较稳定,但湿的CuCl在空气中易发生水解和氧化;②CuCl溶于氯化钠的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释可生成CuCl沉淀,反应式为CuCl2-
CuCl↓+Cl-.
(1)往CuSO4和NaCl混合液中通入SO2可生成CuCl2-和硫酸,请写出反应的离子方程式:______.
(2)在反应(1)中,温度升至70~80℃,并使用NaCl浓溶液,主要目的是______.
(3)在反应(1)中,还原剂除了可用SO2外,还可选用______(填标号).
A.Na2SO3 B.Cu? C.Ag
(4)过滤所得沉淀须迅速用______(填“水”或“95%乙醇”)洗涤、干燥得CuCl成品.
(5)合成氨工业生产中的CO会使催化剂中毒,可通过下列反应除去.
[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)=[Cu(NH3)3]Ac?CO(aq)△H<0,生产中为了提高CO的吸收率,可采用的措施是______.
(6)CuOH不稳定易分解为Cu2O? 298K时,CuOH的Ksp=1.0×10-14,CuCl的Ksp=1.2×10-6.把CuCl固体和NaOH溶液混合,加热,得到红色沉淀,该沉淀的化学式为______.
参考答案:(1)二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和铜离子发生氧化还原反应,反应方程式为2Cu2++SO2+
4Cl-+2H2O=2CuCl2-+SO42-+4H+.
故答案为:2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+.
(2)升高温度或增大反应物的浓度能加快反应速率,所以温度升至70~80℃,并使用NaCl浓溶液,目的是提高CuCl2-的生成速率.
故答案为:提高CuCl2-的生成速率.
(3)选用的还原剂应该具有还原性且不能引进新的杂质,硫酸铜和氯化钠溶液中含有钠离子、铜离子,所以用铜或亚硫酸钠作还原剂时,不能引进新的杂质,如果用银作还原剂能引进新的杂质,故选AB.
(4)CuCl难溶于水和乙醇,干燥的CuCl在空气中比较稳定,但湿的CuCl在空气中易发生水解和氧化,为防止氯化亚铜水解和氧化,应该用95%乙醇洗涤、干燥得CuCl成品.
故答案为:95%乙醇.
(5)该反应是一个气体体积减小、放热的化学反应,所以加压和降温都能使该反应向正反应方向移动,从而提高CO的吸收率.
故答案为:加压降温.
(6)根据题意知,氯化亚铜的溶度积大于氢氧化亚铜的溶度积,溶度积大的物质向溶度积小的物质转化,所以把CuCl固体和NaOH溶液混合,氯化亚铜和氢氧化钠反应生成氢氧化亚铜,加热时,氢氧化亚铜分解生成氧化亚铜沉淀.
故答案为:Cu2O.
本题解析:
本题难度:一般
4、填空题 牙齿表面由一层硬的成分Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq) +OH-(aq)
5Ca2+(aq)+3PO43-(aq) +OH-(aq)
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_______
?。
已知Ca5(PO4)3F的溶解度比上面的矿化物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因_________________________?。
根据以上原理请你提出另外一种促进矿化的方法_______________________?。
参考答案:H++OH-=H2O,使平衡向脱矿的方向移动;5Ca2++3PO43-+F-=Ca5(PO4)3F↓;
加“Ca2+”(或加“PO43-”,或其它合理的方法)
本题解析:本是以生活中牙齿的保护这一实例,给出了一个化学平衡体系,要求通过阅读理解,分析出该题的解题关键是平衡移动就只是,从而将平衡移动原理有有关知识迁移到新情景中,此外,设问中又要求我们进一步根据这一原理,回答保护牙齿的一种方法,这们,可以很好地考查学以致用的能力。
本题难度:一般
5、选择题 已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH =13.0,则下列说法不正确的是
[? ]
A.所得溶液中的c(H+) =1.0×10-13mol/L
B.加入Na2CO3固体,可能生成沉淀
C.所加的烧碱溶液pH= 13.0
D.所得溶液中的c(Mg2+) =5.6×10-10 mol/L
参考答案:C
本题解析:
本题难度:一般