|
高考化学知识点整理《难溶电解质的溶解平衡》试题强化练习(2017年最新版)(八)
2017-07-27 09:57:44
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 高铁酸钾是一种高效的多功能的水处理剂.工业上常采用NaClO氧化法生产,原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,Na2FeO4+2KOH=K2FeO4+2NaOH,主要的生产流程如下:
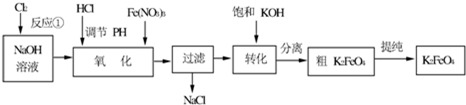
(1)写出反应①的离子方程式______.
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)______Ksp(Na2FeO4)(填“>”或“<”或“=”).
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.
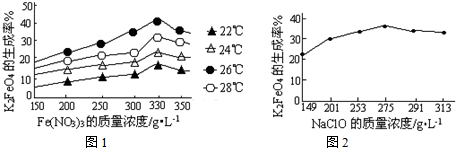
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
①工业生产中最佳温度为______℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为______.
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:______.
③若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:______.
(4)K2FeO4?在水溶液中易水4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
A.H2O?B.CH3COONa、异丙醇?C.NH4Cl、异丙醇?D.Fe(NO3)3、异丙醇.
参考答案:(1)氯气是酸性气体,能和烧碱溶液反应,反应实质为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)根据反应Na2FeO4+2KOH=K2FeO4+2NaOH可知,反应生成溶解度更小的物质,说明此温度下Ksp(K2FeO4)<Ksp(Na2FeO4),故答案为:<;
(3)①寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面,所以工业生产中最佳温度为26℃,因为在该温度下生成高铁酸钾的产率最大,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为330275=1.2,故答案为:26;1.2;
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,原因是NaClO水解呈碱性,Fe(NO3)3水解呈酸性,二者发生互促水解,反应的离子方程式为3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO,
故答案为:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO;
③碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,反应的离子方程式为2 FeO42-+Fe3++8OH-=3FeO43-+4H2O,故答案为:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
(4)为抑制K2FeO4的水解,应在碱性条件下洗涤,可用CH3COONa,为防止K2FeO4的溶解,可用异丙醇洗涤,故答案为:B.
本题解析:
本题难度:一般
2、选择题 下列有关说法正确的是
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.反应Hg(1)+H2SO4(aq) = HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0
C.将纯水加热至较高温度,K变大、pH变小、呈酸性
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
|
参考答案:BD
本题解析:A.AlCl3是强酸弱碱盐,水解产生氢氧化铝和HCl,由于HCl有挥发性,所以随着水分的蒸发而挥发,蒸干得到的是氢氧化铝,再灼烧氢氧化铝分解最后得到的是Al2O3,错误;B.反应Hg(1)+H2SO4 (aq) = HgSO4(aq)+H2(g)在常温下不能自发进行,是由于该反应是体系混乱程度增大的反应,则△H>0, △G>0,正确;C.水是若电解质,升高温度会促进水的电离,所以将纯水加热至较高温度,K变大、pH变小,但是由于水电离产生的H+的浓度与OH-的浓度相等,所以溶液仍然呈中性,错误;D.锅炉中沉积的CaSO4在水中存在沉淀溶解平衡,当用饱和Na2CO3溶液浸泡,会发生沉淀的转化,产生溶解度更小的CaCO3,利用其能够与盐酸反应产生可溶性的物质将其溶解除去,正确,选BD。
考点:考查盐的水解、反应的自发性、弱电解质的电离和沉淀溶解平衡等知识。
本题难度:一般
3、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4+Na2CO3 主要:Cu2++ CO32- + H2O = Cu(OH)2↓+ CO2↑ 次要:Cu2+ + CO32-= CuCO3↓
(2) CuSO4 +Na2S 主要:Cu2+ + S2- = CuS↓ 次要:Cu2+ + S2-+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
[? ]
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:
本题难度:一般
4、选择题 已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。下列关于难溶物之间转化的说法中错误的是? ( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于6.34×10-12mol·L-1
参考答案:A
本题解析:Ksp(AgI)小于Ksp(AgCl),AgI比AgCl更难溶于水,AgCl可以转化为AgI,饱和AgCl溶液中Ag+浓度为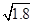 ×10-5 mol·L-1,根据c(Ag+)·c(I-)>Ksp(AgI)时产生AgI沉淀,I-的浓度必须不低于 ×10-5 mol·L-1,根据c(Ag+)·c(I-)>Ksp(AgI)时产生AgI沉淀,I-的浓度必须不低于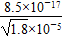 mol·L-1=6.34×10-12 mol·L-1。 mol·L-1=6.34×10-12 mol·L-1。
本题难度:简单
5、填空题 (15分)如图:横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。
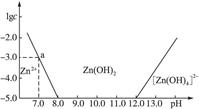
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为____________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是____________。
参考答案:(1)Zn2++4OH-====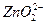 +2H2O +2H2O
(2)10-17? (3)8<pH<12
本题解析:(1)由表中可知随pH增大Zn2+ Zn(OH)2 Zn(OH)2 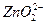 ,故加入足量的NaOH溶液,Zn2+与NaOH反应生成 ,故加入足量的NaOH溶液,Zn2+与NaOH反应生成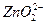 ,离子方程式为Zn2++4OH-==== ,离子方程式为Zn2++4OH-====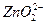 +2H2O。 +2H2O。
(2)当pH=8时开始生成沉淀,此时c(Zn2+)=10-5 mol·L-1,故Ksp=10-5·(10-6)2=10-17。
(3)为提取Zn2+可将Zn2+转化为Zn(OH)2沉淀,此时控制溶液的pH范围为8<pH<12。
本题难度:简单
|