微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列现象与氢键有关的是:
①H2O的熔、沸点比VIA族其他元素氢化物的高? ②小分子的醇、羧酸可以和水以任意比互溶? ③冰的密度比液态水的密度小 ④NH3在水中的溶解度很大? ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定:
A.①②③④⑤⑥
B.①②③④⑤
C.①②③④
D.①②③
参考答案:B
本题解析:氢键不是化学键,一般影响物质的物理性质。水分子稳定和水分子中的化学键强弱有关系,与氢键是无关的,其余和氢键都有关系,所以正确的答案是B。
本题难度:一般
2、选择题 离子键是指带相反电荷的离子之间的相互作用,它是一种静电引力.下列含有这种静电引力作用的物质是( )
A.H2O
B.NH3
C.NaCl
D.HCl
参考答案:C
本题解析:
本题难度:简单
3、选择题 4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8。下列说法不正确的是
[? ]
A.W与Y通过离子键形成离子化合物
B.元素原子半径从大到小的顺序是X、Y、Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8 电子结构
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的元素是Z
参考答案:A
本题解析:
本题难度:一般
4、填空题 (10分)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素。,D跟B可形成离子化合物其晶胞结构如图。
请回答:
(1)A元素的名称是________;
(2)B的元素符号是________,C的元素符号是________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是________________;
(3)E属元素周期表中第________周期,第________族的元素,其元素名称是________,它的+2价离子的电子排布式为________________;
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。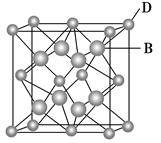
参考答案:(1)氢
(2)F Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键
(3)四 ⅦB 锰 1s22s22p63s23p63d5 (4)CaF2 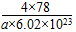 (cm3)
(cm3)
本题解析:A与其他4种元素既不在同一周期又不在同一主族,且A的原子序数最小,所以A为氢。B和C属同一主族,可以确定B是第二周期元素,C是第三周期元素。E是周期表中1~18列中的第7列元素,所以E是锰。D的原子序数比E小5,所以D是Ca。根据晶胞可以确定B和D形成的化合物的化学式为DB2,所以B是氟,C是氯。HF可以形成分子间氢键而HCl没有分子间氢键,所以HF的沸点高于HCl。该晶胞共有4个CaF2粒子,其质量=[78/(6.02×1023)]×4。又已知晶体的密度为a g·cm-3,则晶体的体积为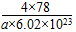 (cm3)。
(cm3)。
点评:晶胞计算是这两年高考物质结构选修题的热点,其中密度的计算,体积的计算,原子间距离的计算较难,需要数学立体几何做基础。
本题难度:一般
5、填空题 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布?。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C?B(选填“>”“<”),第一电离能N>O,原因是?。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为?,其中硫原子采用?杂化,氧原子的价电子排布图为?,任意写出一种SO42-等电子体?。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
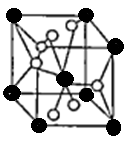
则该氧化物的化学式?(图中钛原子用“O”表示。氧原子用“O”表示)
参考答案:(1)1s22s22p63s23p63d24s2
(2)>? N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O
(3)正四面体;sp3?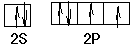 ?CCl4或ClO4-或S2O32-或PO43-
?CCl4或ClO4-或S2O32-或PO43-
(4)TiO2
本题解析:(1)Ti是22元素,核外电子排布式是1s22s22p63s23p63d24s2
(2)非金属性越强,电负性越大,所以电负性C大于B;N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O;
(3)SO42-是AB4型,原子的孤对电子对数是(6+2-4×2)/2=0,所以立体构型是正四面体,采取sp3杂化;氧原子价电子是6,其价电子排布图是, ,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
(4)O的个数是4×1/2+2=4,Ti的个数是8×1/8+1=2,该晶体的化学式为TiO2。
本题难度:一般