微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子。则A的电子式是________,B的结构式是________,C的名称是________。
参考答案: ;H-C≡C-H;一氧化碳
;H-C≡C-H;一氧化碳
本题解析:
本题难度:一般
2、填空题 (14分)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为——————————————。?
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则C中阴阳离子个数比为 ------?。
(3)若D是常见过渡金属,欲将反应B+D→C设计成原电池,正极材料可以采用------ ,
正极的电极反应式为 ——————?。
(4)若D是一种常见的温室气体:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为———?。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 ————?。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为———?。
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,任写一个工业上采用氨水吸收B时,水溶液中发生的氧化还原反应的方程式 —-。?
参考答案:(1) 4NH3+5O2 4NO+6H2O? (2)1:2? (3) 石墨等? Fe3++e-=Fe2+
4NO+6H2O? (2)1:2? (3) 石墨等? Fe3++e-=Fe2+
本题解析:(4)CO32-+CO2+H2O=2HCO3- ?(5)AlO2-?(6)O=C=O? (7)2NH4HSO3+O2=2NH4HSO4等(1)若A能使湿润的红色石蕊试纸变蓝,则A是氨气;C为红棕色气体,则C是NO2。所以D是氧气,B是NO,因此A转化为B反应的化学方程式为4NH3+5O2 4NO+6H2O。
4NO+6H2O。
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则A是钠,D是氧气,B是氧化钠,C是过氧化钠,所以C中阴阳离子个数比为1︰2。
(3)若D是常见过渡金属,则D是铁,B中含有铁离子,C中含有亚铁离子。所以反应B+D→C设计成原电池,正极材料可以采用石墨等。原电池中正极得到电子,因此电极反应式是Fe3++e-=Fe2+。
(4)若D是一种常见的温室气体,则D是CO2。A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,所以A是氢氧化钠,B是碳酸钠,C是碳酸氢钠。因此B转化为C的离子方程式为CO32-+CO2+H2O=2HCO3- 。
(5)(5)若D为氯碱工业的主要产品,B具有两性,则A是铝盐,B是氢氧化铝,D是氢氧化钠,C是偏铝酸钠。所以C溶液中除氢氧根外还存在的阴离子的化学式为AlO2-。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则A是金属氧化物,B是CO2,D是碳,C是CO。CO2是含有极性键的共价化合物,结构式是O=C=O。
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,说明相应的酸性依次增强,所以A是硫化氢,B是SO2,C是三氧化硫,D是氧气。由于亚硫酸盐极易被氧化生成硫酸盐,所以反应的方程式可以是2NH4HSO3+O2=2NH4HSO4。
本题难度:一般
3、推断题 将A在密闭容器中加热得物质的量相等的B、C、D、E四种气体,若冷却到一定温度时,发现有晶体物质X生成,此时原4种气体中只有B没有参加反应,且在相同条件下B相对于氢气 的密度为14,是有毒气体。有关物质的转化关系如下图,其中E在常温下为无色液体,G为淡黄色固体,X、F是一种常见的氮肥。反应①中n(C):n(D)=2:1,反应①②③④在工业生产中均有重要应用,图中部分反应条件及产物未注明。试回答下列问题:

(1)A的化学式:___;C的电子式:____;D的结构式:___。
(2)写出反应②的化学方程式:___ 。
(3)写出J的稀溶液与金属铜反应的离子方程式:___
参考答案:( 1) NH4HC2O4; ; O=C=O
; O=C=O
(2)4NH3 +5O2==4NO+6H2O
(3)3Cu +8H+ +2NO3-==3Cu2++2NO↑+4H2O
本题解析:
本题难度:一般
4、简答题 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则:该反应的反应方程式为?,检验D中阴离子的方法是?.
(2)若A为短周期的金属单质,D为气态单质,C溶液呈强酸性或强碱性时,该反应都能进行.写出反应的离子方程式?;?.
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的化学式(写两种)?、?写出生成E的一个离子方程式?.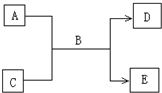
参考答案:
本题解析:
本题难度:一般
5、推断题 如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
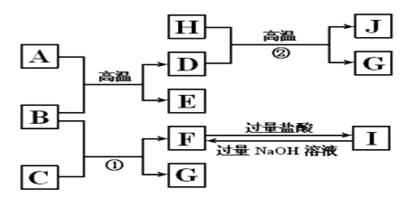
根 据图示回答问题:
(1)写出下列物质的化学式:B________,E________,I________;
(2)写出反应A+B→E+D的一种用途__________________;
(3)反应①的离子方程式是_________________________________________;
反应②的化学方程式是__________________________________________;
(4)J与盐酸反应的化学方程式是__________________?_________________;
反应后的溶液与D反应的离子方程式是___________________________________。
参考答案:共16分
(1) Al Al2O3 AlCl3(每空2分共6分)
(2) (1)焊接钢轨(或其他合理答案)?(2分)
(3)2Al+2OH-+2H2O===2AlO2—+3H2↑?(2分)
3Fe+4H2O(g)  ?Fe3O4+4H2?(2分)
?Fe3O4+4H2?(2分)
(4)Fe3O4+8HCl===FeCl2+2FeCl3+4H2O?(2分)
2Fe3++Fe===3Fe2+?(2分)
本题解析: B是地壳中含量最高的金属元素,B是Al,J是磁性材料Fe3O4,D是单质,D是Fe,H为无色液体,H是H2O, G是单质,G是H2,A是Fe2O3,E是Al2O3,C是NaOH,F是NaAlO2,I是AlCl3。
(1) B是Al,E是Al2O3,I是AlCl3。
(2)铝置换铁,故用途是焊接钢轨。
(3) 反应①是Al和NaOH反应生成H2,离子方程式是2Al+2OH-+2H2O===2AlO2—+3H2↑。反应②Fe和水蒸气的反应,方程式是3Fe+4H2O(g)  ?Fe3O4+4H2。
?Fe3O4+4H2。
(4) J是 Fe3O4与盐酸的反应方程式是Fe3O4+8HCl===FeCl2+2FeCl3+4H2O。
Fe能还原Fe3+,故离子方程式是2Fe3++Fe===3Fe2+。
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论。
本题难度:一般