微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质在水溶液中的电离方程式错误的是?
[? ]
A.CaCl2? = Ca2+?+?2Cl-?
B.NaHSO4? = 2Na+?+?HSO4-
C.HNO3? =?H+?+ NO3-?
D.NaHCO3?= Na+? +?HCO3-
参考答案:B
本题解析:
本题难度:简单
2、填空题 (16分)以下是对化学反应变化过程及结果的研究。按要求回答问题:
(1)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) ?△H2=-29.1kJ·mol-1
乙醇异构化反应C2H5OH(g)=CH3OCH3(g))?△H3=+50.7kJ·mol-1
则乙烯气相直接水合反应
C2H4 (g)+H2O(g)=C2H5OH(g)的△H= 。
(2)在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则a+b________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)用一个离子方程式表示反应:100ml 3mol·L-1NaOH溶液中通入标准状况下4.48LCO2 ;所得溶液中离子浓度大小排列顺序为: ;
(4)废氨水可以转化成氨,氨再设计成碱性燃料电池。下图是该燃料电池示意图,产生的X气体可直接排放到大气中。
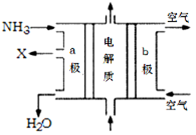
a电极电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
参考答案:(1)-45.5 kJ·mol-1(3分)(2)>(1分) 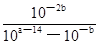 (3分)
(3分)
(3)3OH-+2CO2 =CO32-+HCO3-+H2O (3分)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(3分)
(4)2NH3+6OH--6e- =N2+6H2O(3分);2.7×10-13(3分);>(2分)
本题解析:(1)已知:① 2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1,②2CH3OH(g)=C2H4 (g)+2H2O(g) ?△H2=-29.1kJ·mol-1,③C2H5OH(g)=CH3OCH3(g))?△H3=+50.7kJ·mol-1,则根据盖斯定律可知①—②—③即得到乙烯气相直接水合反应C2H4 (g)+H2O(g)=
C2H5OH(g) △H=-45.5 kJ·mol-1。
(2)pH=a的氢氧化钠溶液中氢氧根等浓度是10a—14mol/L,醋酸是弱酸,溶液中存在电离平衡,pH=b的醋酸溶液中醋酸的浓度大于10—bmol/L。在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则10a—14mol/L>10—bmol/L,所以a+b>14;二者恰好反应,则醋酸的浓度是10a—14mol/L,所以该温度下醋酸的电离常数K=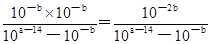 。
。
(3)氢氧化钠的物质的量是0.3mol,CO2是4.48L÷22.4L/mol=0.2mol,即氢氧化钠与CO2的物质的量之比是3:2,所以反应的离子方程式为3OH-+2CO2 =CO32-+HCO3-+H2O。由于碳酸根的水解程度大于碳酸氢根的水解程度,因此所得溶液中离子浓度大小排列顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)a电极通入的是氨气,氨气失去电子,发生氧化反应,则a电极是负极。又因为产生的X气体可直接排放到大气中,所以氧化产物应该是氮气,因此电极反应式为2NH3+6OH--6e- =N2+6H2O;根据铵根的水解平衡NH4++H2O NH3·H2O+H+可知水解平衡常数=
NH3·H2O+H+可知水解平衡常数=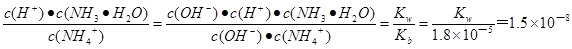 ,解得水的离子积常数Kw=2.7×10-13。常温下水的离子积常数是1.0×10-14,电离吸热,升高温度离子积常数增大,所以T大于25℃。
,解得水的离子积常数Kw=2.7×10-13。常温下水的离子积常数是1.0×10-14,电离吸热,升高温度离子积常数增大,所以T大于25℃。
考点:考查盖斯定律的应用、弱电解质的电离、盐类水解、离子浓度比较以及平衡常数的应用与计算
本题难度:困难
3、实验题 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由 ;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ;
(3)该小组在步骤①中的错误是 ,由此造成的测定结果___________ (填偏高、偏低或无影响)
(4)步骤②缺少的操作是_______ ___ _
(5)右图,是某次滴定时的滴定管中的液面,其读数为___________mL;(上面数字:22,下面数字:23)。
参考答案:24.(1)红色变为无色(2)锥形瓶内溶液颜色的变化
(3)锥形瓶用待测液润洗 偏高
(4)蒸馏水洗后应该再用标准溶液润洗(5)22.60
本题解析:(1)以酚酞作指示剂,用盐酸滴定氢氧化钠溶液终点现象是当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色。
(2)滴定时眼睛注视锥形瓶中颜色变化。
(3)滴定时,锥形瓶水洗后,不能用待装液润洗。否则会使滴定管中液体体积用量偏多,使测定结果偏高。
(4)滴定管水洗后,必须再用标准液润洗,否则会使滴定管中液体浓度偏低。
(5)图中液体体积为22.60mL,
考点:酸碱中和滴定
点评:滴定时滴定管水洗后须用待装液润洗,锥形瓶不能用待装液体润洗。
本题难度:一般
4、选择题 纯水在25℃和80℃时的氢离子浓度,前后两个量的大小关系为
A.大于
B.等于
C.小于
D.不能肯定
参考答案:C
本题解析:
本题难度:一般
5、填空题 写出下列物质在水溶液中的电离方程式
氯化铜______
硫酸铁______
碳酸氢钠______
硫酸氢钠______.
参考答案:氯 化铜是强电解质,电离时电离出自由移动的铜离子和氯离子,CuCl2=Cu2++2Cl-,
硫酸铁强电解质,电离时电离出自由移动的铁离子和硫酸根离子,Fe2(SO4)3=2Fe3++3SO42-,
碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,NaHSO4═Na++H++SO42-,
故答案为:CuCl2=Cu2++2Cl-;Fe2(SO4)3=2Fe3++3SO42-;NaHCO3═Na++HCO3;NaHSO4═Na++H++SO42-.
本题解析:
本题难度:简单