微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某温度下,Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(Ag2CrO4)=1×10-12 mol3·L-3,下列叙述正确的是?
A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C.向0.0008 mol·L- 1的K2CrO4溶液中加入等体积的0.002 mol/L AgNO3 溶液,则CrO42-完全沉淀
D.将0.001 mol·L- 1的AgNO3 溶液滴入0.001 mol·L- 1的KCl和0.001 mol·L- 1的K2CrO4溶液,则先产生AgCl沉淀
参考答案:D
本题解析:饱和AgCl溶液中c(Ag+)=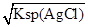 =1.56×10-10mol/L,饱和Ag2CrO4溶液中c(Ag+)=
=1.56×10-10mol/L,饱和Ag2CrO4溶液中c(Ag+)=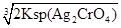 ,显然后者的c(Ag+)大,A错误;AgCl的Ksp只与温度有关,向AgBr的浊液中加入溴化钠溶液,虽然平衡向逆方向移动,但Ksp不变,B错误;两溶液混合后则c(K2CrO4)=0.0004 mol/L,c(AgNO3)=0.001 mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001-0.0004×2=0.0002 mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)=
,显然后者的c(Ag+)大,A错误;AgCl的Ksp只与温度有关,向AgBr的浊液中加入溴化钠溶液,虽然平衡向逆方向移动,但Ksp不变,B错误;两溶液混合后则c(K2CrO4)=0.0004 mol/L,c(AgNO3)=0.001 mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001-0.0004×2=0.0002 mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)=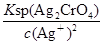 =
=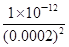 =2.5×10-5mol/L<1.0×10-5mol/L,故c(CrO42-)不能完全沉淀,C错误;根据Ksp (AgCl)、Ksp (Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=
=2.5×10-5mol/L<1.0×10-5mol/L,故c(CrO42-)不能完全沉淀,C错误;根据Ksp (AgCl)、Ksp (Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=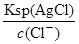 =1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=
=1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=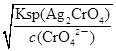 =4.36×10-5 mol/L,故先产生AgCl沉淀,D正确。答案选D。
=4.36×10-5 mol/L,故先产生AgCl沉淀,D正确。答案选D。
本题难度:一般
2、选择题 在溶液中有浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39; Ksp[Cr(OH)3] =7.0×10-31 Ksp[Zn(OH)2] =1.0×10-17; Ksp[Mg(OH)2] =1.8×10-11当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
[? ]
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
参考答案:A
本题解析:
本题难度:一般
3、选择题 在BaSO3(s)?Ba2+(aq)+SO32- (aq)平衡体系中,下列措施可使沉淀量减少的是( )
A.加入K2SO3(s)
B.加入稀HNO3
C.加入稀盐酸
D.加入K2SO4(s)
参考答案:A、加入K2SO3(s),K2SO3电离产生SO32-,SO32-的浓度增大,平衡逆向移动,沉淀量增加,故A错误;
B、加入稀HNO3,稀HNO3能氧化BaSO3生成BaSO4,BaSO4的质量比BaSO3大,沉淀量增加,故B错误;
C、加入稀盐酸,稀盐酸能与SO32-反应生成水和SO2,SO32-的浓度减小,平衡正向移动,沉淀量减少,故C正确;
D、加入K2SO4(s),K2SO4(s)电离产生SO42-,SO42-能与Ba2+结合生成BaSO4,BaSO4的溶解积比BaSO3更小,所以BaSO3沉淀转化为BaSO4沉淀,沉淀量增加,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 把Ca(OH)2放入蒸馏水中,一段时间后达到平衡,Ca(OH)2(s)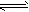 Ca2+(aq)+2OH-(aq),下列说法正确的是
Ca2+(aq)+2OH-(aq),下列说法正确的是
[? ]
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量减少
参考答案:D
本题解析:
本题难度:一般
5、填空题 难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各种离子的浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH)2 Cu2++2OH-,Ksp=c(Cu2+)·[c(OH-)]2=
Cu2++2OH-,Ksp=c(Cu2+)·[c(OH-)]2=
2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于__________________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为__________________。
参考答案:(1)5
(2)6
本题解析:
本题难度:一般